ヤ行
薬物トランスポーターと薬剤応答性
薬剤が薬として効果を発揮するには、まず体内に入ってターゲット部位を十分な時間だけ薬効濃度を保ちながら存在しなければならない。
今後、医療システムが入院/通院から在宅医療重視へと変化するに従い、経口薬剤の市場が拡大すると予測される。
薬剤が経口投与に適したものであるためには、まず小腸上皮細胞を透過しなければならない。
さらに、抗鬱剤やアルツハイマー病治療薬のような中枢神経系で作用する薬剤であれば、血液脳関門も通過できるように薬剤分子をデザインしなければならない。
薬物トランスポーターや薬物代謝酵素は薬物の体内動態プロファイル(吸収、分布、代謝、排泄、ターゲット部位での薬剤実効濃度)を規定し、ひいては薬剤の全体的な薬理効果をも左右するのである。
ヒトゲノムDNAの塩基配列解析が急速に進み、これまで単離された遺伝子の約15%はトランスポーターをコードする遺伝子であることがわかった。現在までに分子レベルで構造が明らかにされたトランスポーターのなかで、薬物またはその代謝物の輸送にかかわる薬物トランスポーターは、1次性能動輸送系、2次性能動輸送系を含め、きわめて多用である。
ABCG2(P-糖蛋白質/MDR1)やABCC2(cMOAT/MRP2)、ABCG2(BCRP)といったABC(ATP-binding cassette)トランスポーターをはじめ、溶質(SLC)トランスポーターであるペプチドトランスポーター(PEPT)、アニオントランスポーター(MCT、OAT、OATP、NPTなど)、カチオントランスポーター(OCT、OCTN)は小腸や腎臓の上皮細胞、幹細胞、脳血管内皮細胞に発現し、薬物輸送に関与している。
薬物トランスポーターの分子機構の解明とその薬物動態上の意義を定量的に解析することは、ポストゲノム時代における合理的な創薬分子デザイン戦略、ターゲット部位への特異的な薬剤デリバリーの開発に大きく貢献すると考えられる。
薬物トランスポーター遺伝子
疾病が多くの遺伝子と環境因子が複合的に関係した結果であるように、薬に対する効果も患者1人1人で異なる。
事実、薬の副作用の現われ方は患者間で大きく異なり、重篤な副作用の場合には患者の生命が脅かされる。
理想的な薬というのは、病気の治療または予防に有効で、副作用がまったくないものである。
しかし現実には、たとえ薬効が最高に良い薬だったとしても、それが効く対象疾病患者はその全員ではなく、そのうちの一部である。
ある一部の患者では、薬の効果がほとんど、あるいはまったくなかったり、または別の患者では、重篤な副作用が現われる場合もある。
この様な事が起きるのは、薬物トランスポーター遺伝子が関係しています。
近年、ヒトにおいて非常に多くの薬物トランスポーターがクローニング・機能解析されており、薬物の吸収に関与する小腸、薬物の血中からの排泄に関与する肝臓や腎臓、また、脳などの非常に重要な器官を守るために、血液中から物質の移行を厳密に制限する種々の関門組織(血液脳関門、血液胎盤関門など)の両側膜に複数のトランスポーターが発現・機能していることが明らかにされつつある。
薬物トランスポーターの大きな特徴としては、個々の薬物トランスポーターの基質特異性が非常に広範であり、薬効群を越えて多様な構造の化合物を輸送することが挙げられ、1つのトランスポーターの機能変化が、幅広い薬物の体内動態の変動を引き起こす可能性があることを留意する必要がある。
これまで数多くのトランスポーターについて遺伝子多型解析が進められているが、薬物動態や薬効・副作用との関連を解析する臨床研究を企画できるほど高頻度な遺伝子多型は限られていることや、複数の臨床試験の間で結果が相互に一致しない事例があることなどから、機能変動について統一した見解が得られているトランスポーターの遺伝子多型は数少ない。
誘導脂質
単純脂質や複合脂質から、加水分解によって誘導される
疎水性化合物を誘導脂質という。今日では、生体中で遊離して存在する各種イソプレノイドもここに含めることが多い。
脂肪酸・テルペノイド・ステロイド・カロテノイドなど、多様な物質が知られている。
身体の構成、エネルギー貯蔵の他、ホルモンをはじめとする生理活性物質としてはたらく。
遊走
単細胞生物だけでなく、多細胞生物の体内にも一つの細胞で組織内を自由に移動し活動するものがある。
それらの細胞を遊走細胞といい、白血球などのアメーバ状細胞などがその例である。
白血球は動物の血液・組織液中にあって呼吸色素(ヘモグロビンなど)をもたない細胞の総称である。
血液中の白血球は免疫にかかわる細胞で、白血球にはリンパ球やマクロファージなどがある。
リンパ球には、異物(抗原)を認識し、抗原と直接に反応するT細胞と、抗原と反応する抗体をつくるB細胞がある。これらの白血球は血管とリンパ液を通って体内を循環している。マクロファージは、体内に侵入した抗原を細胞内に取り込んで消化するほかに、抗原の情報をT細胞に伝える。多くの異物を取り込むと白血球も死に、分解産物とともに膿(うみ)になる。
ユビキチン (ubiquitin)
76個のアミノ酸からなるタンパク質で、他のタンパク質の修飾に用いられ、
タンパク質分解、DNA修復、翻訳調節、シグナル伝達などさまざまな生命現象に関わる。
至る所にある (ubiquitous) ことからこの名前が付いた。
ユビキチンは
不要なタンパク質の除去を始めとして、
DNA修復、シグナル伝達など多彩な
機能を持っている。
この機能の差は複数のユビキチンがどのような結合の仕方をするか(主にどのリシンをポリユビキチンの結合に使うか)で変わってくる(→後述)。
まずユビキチン化はフォールディングが異常なタンパク質(ミスフォールドタンパク質)や不要になったタンパク質を細胞から除去するためにも重要な役割を持っており、このシステムをタンパク質の品質管理と呼ぶ。
新生タンパク質の約30%がミスフォールディングタンパク質であると言われており、まずはじめに、これらのタンパク質をhsp90等の分子シャペロンが修復しようと試みる。
修復が不可能なほどタンパク質の構造がひどく壊れていたときには小胞体から細胞質に輸送され、分子シャペロンによって品質管理ユビキチンリガーゼとして働く C-terminus of Hsc-70-interacting protein (CHIP) などへと運ばれた後にユビキチン化を受け、プロテアソームによって分解される。
これらの機構を
小胞体関連分解(Endoplasmic Reticulum(ER)-associated degradation; ERAD)と呼ぶ。この経路を利用して作られた医薬品が抗悪性腫瘍剤ボルテゾミブであり2006年12月に日本国内で発売開始された。
近年、
ユビキチン-プロテアソーム系はクラスⅠMHC分子を介した細胞内由来タンパク質のCD8陽性T細胞(キラーT細胞)への提示にも関与していることが明らかとなっている。
抗原提示細胞の細胞質中にある、または細胞質中に取り込まれたタンパク質(ペプチド)はユビキチン-プロテアソーム系により短いペプチド断片へと分解された後に、小胞体(ER)上のTAPを介してER内にとりこまれ、ER内のクラスⅠMHC分子と会合し、細胞表面に輸送されてT細胞エピトープとして提示される。
また、サイクリン-CDK(後述細胞周期参照)複合体のユビキチン化は細胞周期の制御に重要な役割を果たしている。
ポリユビキチン:ユビキチン同士はいくつかの結合の仕方があり、それによって機能が異なってくる。
ユビキチンには7つのリシン残基(Lys, K)があり、ポリユビキチンを形成する際、このリシンと別のユビキチンのC末端にあるグリシンがアミド結合を作るが、どのリシンを結合に使うかでユビキチンの機能が異なってくる。
また、N末端のメチオニンとC末端のグリシンが結合してポリユビキチンを形成することもある。
以下に、主なユビキチン(ポリユビキチン)鎖を整理する。
K48ポリユビキチン鎖:48番目のリシン(K48, Lys48)を介したポリユビキチン。
プロテアソームによる分解シグナルを伝える。
K63ポリユビキチン鎖:63番目のリシン(K63, Lys63)を介したポリユビキチン。
このポリユビキチン鎖がタンパク質と相互作用してシグナル伝達やDNA修復を行う。
直鎖状ポリユビキチン鎖:1番目のメチオニン(M1, Met1)を介したポリユビキチン。
NF-κBの活性化に関わる。
ユビキチンシステム
標的タンパク質に対するユビキチンの付加はユビキチンシステムと呼ばれ、3つの酵素、ユビキチン活性化酵素 (E1)、ユビキチン結合酵素 (E2)、さらにユビキチン転移酵素(ユビキチンリガーゼ) (E3) によって行われる。
標的タンパクのリシンの側鎖のアミノ基 (-NH2) とユビキチンのC末端のグリシンがアミド結合することでひとつめのユビキチンが付加され、更にそのユビキチンの中のリシンの側鎖に更に次のユビキチンが付加する、といった具合に複数のユビキチンが次々と付加されることがわかっている。
ユビキチンリガーゼは基質タンパク質のdegronと呼ばれる配列を認識して結合する。Degronの認識にはタンパク質の翻訳後修飾(リン酸化、水酸化、脱アセチル化等)が重要な役割を果たす場合があり、また、どのような修飾がユビキチン化に関与するかはそれぞれの基質によって異なる。
例としてレセプターにはリン酸化が、HIF-1αには水酸化がそれぞれ選択的ユビキチン化に必要である。
ポリユビキチン化されたタンパク質はプロテアソームと呼ばれる巨大な酵素複合体のプロテアーゼによって分解される(ユビキチン-プロテアソームシステム)。
また、一度標的タンパク質に結合してプロテアソームに取り込まれたユビキチンは、脱ユビキチン化酵素(DUB)によって基質から除去され、再利用される。またシグナル伝達やクロマチンの修飾にも用いられる。
ユビキチン化
ユビキチン化はフォールディングが異常なタンパク質(ミスフォールドタンパク質)や
不要になったタンパク質を細胞から除去するためにも重要な役割を持っており、このシステムを
タンパク質の品質管理と呼ぶ。新生タンパク質の約30%がミスフォールディング(不良品)タンパク質であると言われております。
予後指標
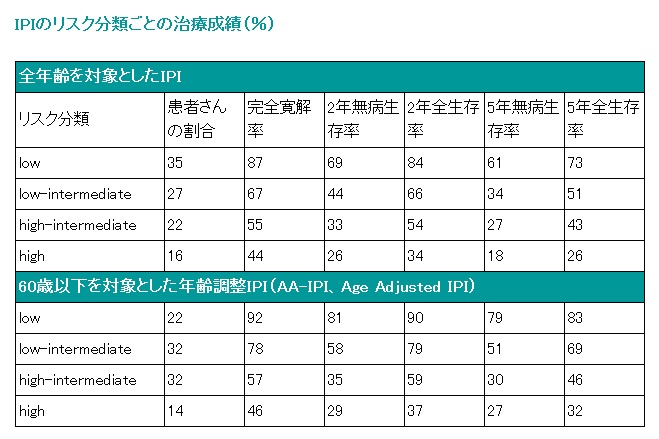
■非ホジキンリンパ腫に対する予後指標─IPI
IPI(International Prognosis Index、国際予後指標)とは、CHOPなどの化学療法を受けたB細胞性非ホジキンリンパ腫の中悪性度(aggressive lymphoma)の患者さんを対象に行われた研究によって示された予後指標ですが、その他のいくつかの非ホジキンリンパ腫にもある程度はあてはまることが示唆されています。
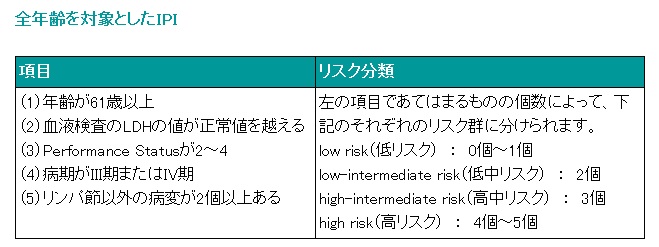
 全身状態 PS(パフォーマンスステータス)
全身状態 PS(パフォーマンスステータス)
ECOG(Eastern Cooperative Oncology Group)によってグレード毎に分類される。
0 なんら制限を受けることなく、発病前と同等に社会生活が行える
1 肉体労働は制限を受けるが、歩行、軽労働や坐業はできる。たとえば軽い家事や事務労働など。
2 歩行や身のまわりのことはできるが、労働はできない。日中の50%以上は起居している。
3 身のまわりのある程度のことはできるが、日中の50%以上は就床している。
4 身のまわりのことは何もできず、終日就床している。

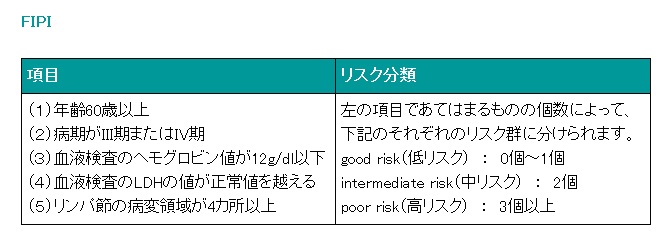
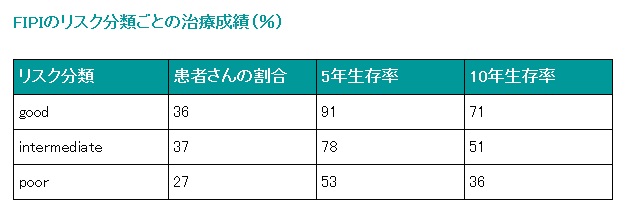
■濾胞性リンパ腫に対する予後指標─FIPI
非ホジキンリンパ腫の中悪性度(aggressive lymphoma)の患者さんを対象に行われた研究によって示されたIPIでは、濾胞性リンパ腫(follicular lymphoma)を含むその他のいくつかのリンパ腫に対してもある程度あてはまることが示唆されていましたが、不完全な面もありました。そこで、濾胞性リンパ腫の患者さんを対象に行われた研究によって示された予後指標として、濾胞性リンパ腫を対象とするFIPI(Follicular International Prognosis Index)があります。
■ホジキンリンパ腫に対する予後指標─IPS
IPS(International Prognosis Score)は、進行期のホジキンリンパ腫の患者さんを対象に行われた研究によって示された予後指標です。ホジキンリンパ腫は非ホジキンリンパ腫と比較すると治療成績が良好なので、リスクが低いと予想される患者さんには、治療が過剰なものとならないようiにする必要があります。


幼若化(blastogenesis, blast formation)・脱分化
ヒト(の身体)を構成する60兆とも言われる細胞は、1個の受精卵から発生を開始し、当初は形態的機能的な違いが見られなかった細胞は各種幹細胞を経て組織固有の形態および機能をもった細胞へと変化してゆく。
この
形態的機能的な細胞の変化を分化という。
細胞の発生学的特徴の一つとして、未分化細胞ほど細胞周期が短く盛んに分裂増殖を繰り返す傾向がある。
通常、
分化の方向は一方向であり、正常組織では
分化の方向に逆行する細胞の幼若化(=脱分化)は、損傷した組織の再生などの場合を除き、発生しない。
しかし、
がん細胞は特徴の一つに幼若化/脱分化するという性質があるため、その結果分化度の高い(=高分化な)がん細胞や、ときには非がん組織から、
低分化あるいは未分化ながん細胞が生じる。
細胞検体の検査を行ったとき、
細胞分化度が高いものほど臓器の構造・機能的性質を残しており、比較的悪性度が低いと言える(ただしインシュリノーマ等の内分泌腺癌など、例外はある)。
また、通常は分化度の低いものほど転移後の増殖も早く、治療予後も不良である。
化学療法は、特定の細胞周期に依存して作用するものが多いため、細胞周期が亢進している分化度が低いがんほど化学療法に対して感受性が高いという傾向がある。
▼ ヤ行先頭へ