慢性炎症からがんに至る過程にもう一つのステップ「エピジェネティクス」
一部の慢性炎症が分子レベルで発がんを促すことが広く知られるようになってきましたが、
慢性炎症からがんに至る過程には、もう一つのステップが存在しています。
「もう1つのステップとは、遺伝子のエピジェネティックな制御が異常になることです」
私たちの体は皮膚、胃、肝臓など様々な組織から出来ており、これらは別々の細胞で構成されています。
どの細胞も基本的には同じ遺伝情報を持っているのに、別々の細胞になれるのは、使う遺伝子と使わない遺伝子に目印をつけているからなのです。
エピジェネティクスとは、これらの目印を解明する学問です。
エピジェネティクスの研究は2000年代になって盛んになりました。
エピジェネティクスの歴史的な用法や研究者による定義の違いもあり、その内容は必ずしも一致したものではありません。
一般的には、リッグス(1996年)の定義のように理解されています。
しかしながら、いくつかの定義あるいは説明が存在し、結果として、何を意味するべきかについては議論があります。
最新の定義はBergerら、2009年です。
皮膚から胃ができないことに象徴されるように、エピジェネティックな目印の特徴は、いったんつくと、容易にははずれないということです。
細胞内のDNAは、
ヒストンとよばれるタンパク質に巻きついてできています。
エピジェネティックな目印には、DNAにつく目印(DNAメチル化)とヒストンにつく目印(ヒストン修飾)の2つが知られています。
DNAメチル化異常を誘発する要因
最も古くから知られているものは、
加齢です。
その他に、大腸の炎症が持続する
潰瘍性大腸炎、ウイルス感染、性ホルモン、慢性炎症、喫煙、化学物質、細菌感染、食事などもDNAメチル化の促進因子であることが分かってきています。
例えば、胃がんの原因であるヘリコバクター・ピロリ(ピロリ菌)感染によって、
胃粘膜に強力にDNAメチル化異常が誘発されることを明らかになりました。
(論文、Maekita et al., 2006 [PubMed])
また、食道粘膜では、喫煙期間の長さとそのメチル化異常の量とが相関する遺伝子があることが分かりました。
(論文、Oka et al., 2009 [PubMed])。
化学物質の中には、薬剤や金属化合物等、DNAメチル化状態を変えるものが一部報告されています。
DNAメチル化自体は悪いものではなく、生理的にある程度は存在しているものです。
DNAメチル化を異常に低下させるものとしてはメチル基供与体S-adenosyl-L-methine(SAM)の不足があります。
食事成分の中にSAMの合成反応に関わる物質があり、それらの摂取・欠乏によってDNAメチル化状態が影響を受けることが、主に動物を使った実験で報告されています。
エピジェネティクス機構には、DNAのメチル化や染色体を構成するタンパク質である「ヒストン」(DNAは「クロマチン」という構造を作って核内に収納されていますが、その時にDNAが巻き付くタンパク質のこと)のメチル化=「
ヒストン修飾」などさまざまな修飾が起きており、
細胞ごとに固有の修飾パターンで、遺伝子の発現に基づく細胞機能を制御しています。
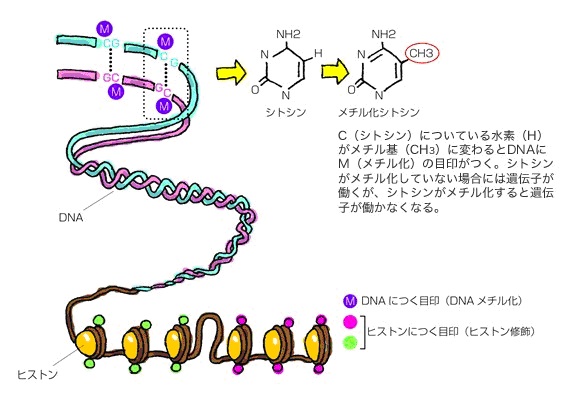 DNAメチル化とは、アデニン(A)・チミン(T)・グアニン(G)・シトシン(C)と4つある塩基の内、シトシンの炭素原子にメチル基「CH3」が付加される現象のことを言います。このメチル化によりゲノムの構造や機能が変化し、遺伝子発現に影響を与えます。
DNAメチル化とは、アデニン(A)・チミン(T)・グアニン(G)・シトシン(C)と4つある塩基の内、シトシンの炭素原子にメチル基「CH3」が付加される現象のことを言います。このメチル化によりゲノムの構造や機能が変化し、遺伝子発現に影響を与えます。
関与する生命現象は、発生、細胞分化、ゲノム安定性維持や発がん等です。
ヒストン修飾とは、ヒストンにアセチル基やメチル基などが付くことを言います。クロマチンの構造が変わることで遺伝子のオン・オフが調節されますが、その構造変化はDNAメチル化だけではなく、ヒストン修飾によっても制御されています。
このように、
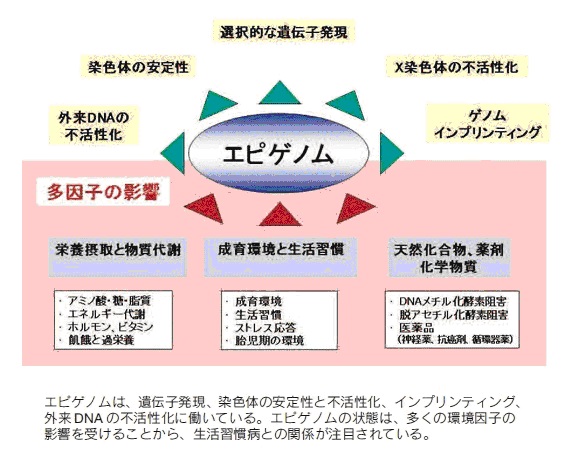
染色体を構成するDNAやタンパク質が、「メチル化」や「アセチル化」などの後天的(こうてんてき)な化学修飾を受けており、この特定の細胞に固有なゲノム修飾状態全体を、「エピゲノム」と呼びます。
DNAメチル化は遺伝子発現に関わるため、その制御機構を理解する上で重要ですが、
生殖細胞で起きるDNAメチル化についてはこれまであまり理解が進んでいませんでした。
生体を構成する細胞は、
生殖細胞(精子、卵子など)と体細胞に大別されます。
体細胞は身体を形作るのに必要で個体一代限りの細胞ですが、生殖細胞は次代に遺伝情報を受け渡す重要な役割を持っており、世代をつなぐ「不死」の細胞といえましょう。
このように
体細胞と生殖細胞では異なる役割を持つため、そこで働く遺伝子も当然ながら異なっており、生殖細胞だけで発現し機能する遺伝子が多数存在します。
中には極端なものもあり、例えば、雄の生殖細胞特有の遺伝子の一部は、正常な体細胞では発現しないが、
がん細胞では発現することがあるのです。
これらの遺伝子は、
「がん精巣抗原」遺伝子と呼ばれています。
がん精巣抗原はがん細胞の同定に有効であり、また、がんの免疫治療の標的となる可能性も指摘されているところです。
ヒトには260以上のがん精巣抗原遺伝子が存在し、その4割以上が性染色体である
X染色体にあることが知られています。
しかし、
なぜ生殖細胞とがん細胞で共通して発現するのか、その意義やメカニズムは不明なままです。
(病気の起源「がん」 NHKスペシャルより)
生活習慣病のエピジェネティクス
エピゲノムの状態は、多くの環境因子の影響を受けることが判明し、生活習慣病との関係が注目されてきました。
DNAのメチル化やクロマチン修飾は、細胞応答として変化しますが、影響を与える因子には、栄養や食事、物質代謝、成育環境と生活習慣、天然化合物、薬剤・化学物質などが挙げられています。
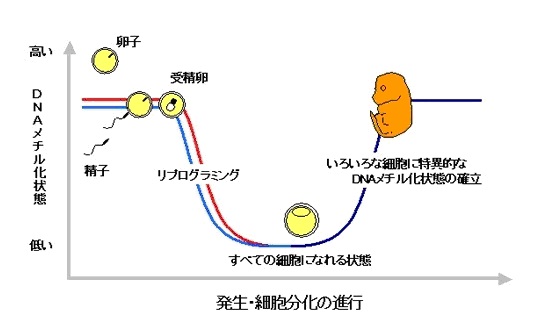
リプログラミングとDNAメチル化
精子の遺伝子も卵子の遺伝子も相当なDNAがメチル化されていますが、受精したとたんメチル化が御破算になっていったんすべて消えてしまいます。
この過程を、
細胞分化のプログラムがいったんなくなる、ということで、「リプログラミング・初期化」と呼びます。
受精卵が何にでもなれるのは、このリプログラミングが生じるためです。
そして、発生が進行して受精卵が分化していくプロセスの中で、それぞれの細胞の遺伝子DNAに、それぞれのメチル化パターンが生じて特定の遺伝子だけが働くようになっていく(エピジェネティクス)のです。
受精後、まず、DNAの脱メチル化が生じて、どのような細胞にでもなれる状態になります。
次に、発生が進むにつれて、いろいろな細胞に適したDNAメチル化状態が確立されます。
DNAのメチル化は、エピジェネティクスによって遺伝子の働きが制御されます。
不必要な遺伝子を働かせないようにして、それぞれの細胞をつくり出し、私たちのからだを正常に保つ働きをしています。
けれども、DNAのメチル化が異常を起こしますと、それぞれの細胞にとって必要な遺伝子の働きを阻害することや、抑制されなければならない遺伝子を促進してしまう場合が出てきます。
たとえば、
がんの細胞を採取するとDNAのメチル化に異常があることが分かっています。がんは、がんを抑制する遺伝子の働きによって防がれているのですが、たとえば、
メチル化の異常によってがん抑制遺伝子が働かなくなり、発がんするケースもあります。
このような場合は、エピジェネティクス状態を制御する薬剤によってDNAのメチル化を正常化することができれば、がんを治療することも可能になると考えられているのです。
このほか、先天性疾患や統合失調症、生活習慣病などの後天性疾患、老化の制御などでもエピジェネティクス制御がかかわっているとの報告があります。
ただ、まだ
エピジェネティクスに関しては、その輪郭と重要性は分かっていて、そこに大きな科学的な意味のある大陸が横たわっていることは間違いないのですが、その大陸の内部に何があるのか分からない、そんな状況なのです。
哺乳類受精卵のリプログラミングに重要な遺伝子を世界で初めて発見
近畿大学生物理工学部(和歌山県紀の川市、学部長:細井美彦)の松本和也教授・畑中勇輝大学院生(博士後期課程3年)らの研究チームは、哺乳類の受精卵が全ての細胞に自律的に分化する能力(分化全能性)を獲得するために必要なプロセスである「エピジェネティック情報(遺伝子の発現を記憶するための情報)のリプログラミング(書き換え)」において重要な働きをする遺伝子「
GSE」を、世界で初めて同定しました。
この研究成果は今後、精子や卵のもとになる「始原生殖細胞」の形成時やiPS細胞(人工多能性幹細胞)の樹立時に起こるエピジェネティック・リプログラミングの理解にも貢献することが期待されます。
それにより、いまだ低率である体細胞クローン個体の作出効率や、iPS細胞の作成効率の改善などに寄与することも期待されています。
本研究成果は、米国のオンライン科学雑誌「PLOS ONE」 (2013年4月1日付け:日本時間4月2日)に掲載されました。
ピロリ菌が細胞のリプログラミングを行うことで胃がんに至ることが判明
ピロリ菌感染した胃などに腸の細胞が現れる現象で胃がんの前がん病変とされる「腸上皮化生」発症において、幹細胞性に関わるリプログラミング遺伝子が異常に活性化され、胃細胞から腸細胞への病的な細胞分化が引き起こされることを明らかにしと発表した。
成果は、東大大学院 医学系研究科 病因・病理学専攻 微生物学講座の畠山昌則教授らの研究グループによるもの。研究の詳細な内容は、現地時間2012年10月29日付けで米国科学雑誌「米科学アカデミー紀要(PNAS)」オンライン版に掲載された。
胃がんは、世界で年間70万人が死亡する原因となっているがんだ。特に日本は胃がんの罹患率が非常に高く、胃がんはがんによる死亡原因の中で2番目となっている。胃がんの種類の中で大部分を占める
「分化型胃がん」は、「腸上皮化生」と呼ばれる胃粘膜病変を前がん病変として発症すると考えられているところだ。
腸上皮化生は、胃の粘膜の中に腸の細胞(多くは小腸の細胞)が出現する現象だが、どのような仕組みで胃の細胞が腸の細胞に変化するのか、なぜ胃がんの発症につながるのかについては長年不明のままだった。
ピロリ菌の感染は胃がんの重要な危険因子として知られているが、中でも「
CagA」という病原因子を産生するタイプのピロリ菌感染は、CagAを作らないタイプのピロリ菌感染と比較して、腸上皮化生を含めた胃粘膜病変の発症とより強く相関する。
CagAはピロリ菌が保有するミクロの注射針により胃上皮細胞内に注入される畠山教授らはこれまで、CagAの持続的侵入により、胃の細胞内に本来腸に特異的に存在する転写因子「
CDX1」が異所性に発現されることを明らかにしました。
腸上皮化生を示すヒトの胃粘膜にはCDX1が異所性発現していることが知られており、動物実験の結果からCDX1を発現させた胃粘膜では腸上皮化生が発症することが報告されています。
このことから、CDX1が腸上皮化生の発症機構に関わることが推察されますが、
CDX1がどのようなメカニズムで胃の細胞を腸の細胞に変換させるのかについてはまったくわかっていませんでした。
今回の研究では、腸上皮特異的転写因子CDX1を条件依存的に異所性発現させるヒトの胃の細胞株を樹立し、CDX1が
転写因子としてどのような遺伝子群の発現を制御しているのかを、DNAマイクロアレイ解析技術を用いて全ヒト遺伝子の中から探索が行われた形です。
その結果、CDX1は胃の細胞において、iPS細胞やES細胞の樹立・維持に関与する「
SALL4」ならびに「
KLF5」という
「リプログラミング遺伝子(幹細胞性遺伝子)」を異常に活性化することが判明したのである。
一方、
CDX1を発現した胃の細胞では、腸の幹細胞に見られる遺伝子群の発現に続いて、腸の分化した細胞に見られる遺伝子群の発現が観察され、さらにSALL4とKLF5を発現できないようにした細胞ではCDX1によるこれらの遺伝子の発現が起きにくくなることが明らかにされた。
以上のことから、
CDX1はSALL4・KLF5という幹細胞性の転写因子を異常に活性化させることにより、胃の細胞を一度幹細胞様の状態に脱分化した後に腸の細胞へ再分化させていることが示唆されたのです。
今回の研究は、胃の細胞が腸の細胞に病的変換する際に、一度ある程度未分化な状態に戻ることで複数種の異常な腸細胞を作り出していくというモデルを示すものだ。
ピロリ菌感染による腸上皮化生の発症において、幹細胞性転写因子が異所性に異常発現・活性化する結果、iPS細胞に見られるような
細胞分化のリセット機構が実際の病気の進行過程で起きることを示した初の報告になる。
組織幹細胞の性質はさまざまな細胞生物学的比較で「がん幹細胞」に近い部分が多々あり、胃細胞のリプログラミングにより生じた未分化な状態の細胞は、胃の細胞にも腸の細胞にも分化できる異常な能力を持つと共に容易にがん化しやすい性質を獲得すると考えられるという。
すなわち、こうした細胞のリプログラミング機構は腸上皮化生のみならず胃がん発症にも深く関わることが推察され、この機構を阻止することで胃がん発症の予防が可能になることが期待されると、畠山教授らはコメントしています。
遺伝子変異またはエピジェネティクス異常が起きると細胞は癌化する
がん細胞をリプログラミング(初期化)すると癌が治る?
遺伝子変異またはエピジェネティクス異常を修復すれば癌化を正常に戻す事ができると考えられる。
体細胞からIPS細胞へのリプログラミングと同様に癌細胞をリプログラミングすることで正常な細胞に戻すという概念が定着しています。
がん細胞であるマウスメラノーマ細胞をリプログラミングさせたという論文報告があり、他の研究チームからも、培養皿でヒト肝がん幹細胞に抗がん剤など2種類の化学物質を加えると、
2日後、85~90%のがん細胞が正常の肝細胞になり、さらに2遺伝子と2種類の化学物質を加えてiPS細胞にリプログラミングさせ、正常な肝細胞に戻すことにも成功したと発表しています。
遺伝子や化学物質を与えて細胞を正常に戻すリプログラミング療法は、がんや糖尿病の治療につながると期待されています。
副作用がなく、難病も根治できる治療になるとして、大手製薬会社も開発に力を入れつつあると報道されています。
しかしながら、がん細胞が正常細胞にリプログラミングされたとしても、実際にがん治療を実現させるためには、培養皿中ではく、生体中のがん細胞を100%の効率で正常細胞へリプログラミングする必要があります。
一般的に、画像検査で発見される早期がんでも1億個のがん細胞からなると考えられています。
仮に99.9%の効率でがん細胞を正常細胞へリプログラミングできたとしても、10万個のがん細胞から再発することになるため、有効ながん治療とはなり得ません。
従って、全く新しい概念に基づいて、iPS細胞のがん創薬応用を提唱する必要があります。
がんのイニシエーター 慢性炎症
マイクロバイオーム(微生物群ゲノム)

