マイクロバイオームとは
いわゆる腸内細菌に代表される生物に寄生する膨大な数の細菌が、マイクロバイオームと呼ばれるまとまりをなし、
ヒトの細胞とやり取りをしながら、私たちの身体の生理機能をコントロールしているという考え方です。
がん細胞は、正常な細胞の突然変異で発生増殖すると言う考え方だけではなく、遺伝子自体は正常であるにも関わらず、その周辺の要因でがん化するケースもあることがわかってきました。
前述の
ピロリ菌が細胞のリプログラミングを行うことで胃がんに至ることが判明しました。
そして、
ヘリコバクターピロリが作り出すCagA(ギャグエー)と言うたんぱく質(代謝産物・マイクロバイオーム)が胃の表面の粘膜にすみ着いたピロリ菌から粘膜の上皮細胞に注入されると、細胞の働きに様々な混乱が起きて、発がんにいたります。
従来の説では、一旦がん化した細胞が元に戻ることはありえませんが、前述のエピジェネティクスやマイクロバイオームの考え方では、周辺の要因を改善することで癌がリプログラミング(初期化)され、元の状態に戻る余地があるのです。
稀に末期のがん患者が完治する例が報告されています。
これを
「がんの自然退縮」と言い医学的なエビデンスは不明です。
また、
がんに有効だと思われる代替治療があり、多くの末期がんからの生還例があります。「笑い」然り、「病気に対する受け止め方」然り、バイオフィードバック療法、サイモントン療法、気功や食事療法等もそうです。
そういった今まで科学的な根拠を示しにくいものが、実は有効であるという事がわかってきました。
健常人の正常微生物群の構成が初めて明らかにされました
米国国立衛生研究所(NIH)のヒトマイクロバイオームプロジェクト
人体の正常な細菌構成を明らかに!
ゲノム塩基配列決定技術により健康な成人と共生する微生物群の参照データが初めて作成されました。
NIHプレスリリース2012年6月13日(一部日本語文法としておかしな部分がございます。)
微生物群は人体のほぼあらゆる部分に生存し、皮膚表面上、消化管内、鼻腔内に存在する。一部の細菌は疾患を引き起こすこともあるが、ほとんどの場合、
微生物群は宿主であるヒトと共生し、ヒトの生存に不可欠な機能を提供する。
今回、米国国立衛生研究所(NIH; National Institutes of Health)が設立した研究者らからなるコンソーシアムにより、健常人の正常微生物群の構成が初めて明らかにされ、多くの洞察とともに少しばかりの驚くべき知見がもたらされた。
例えば、
ほぼ全てのヒトは、疾患を引き起こすことが知られている微生物である病原体を保持していることが明らかになった。
しかし、病原体は健康な人に疾患を引き起こすことはなく、単に宿主や人体に生存する微生物の集合体であるヒトマイクロバイオーム(微生物群ゲノム)と共存するだけである。
今回、
なぜ一部の病原体が致死的になるのか、そしてそれはどのような状況下においてであるかが明らかになることは間違いなく、それは微生物がどのようにして疾患を引き起こすのかに関して現在の概念を変える可能性がある。
2012年6月14日にNature誌およびPublic Library of Science (PLoS)の複数のジャーナルに協調して発表された一連の研究報告において、およそ80の大学および研究機関の約200人のヒトマイクロバイオームプロジェクト(HMP; Human Microbiome Project)のコンソーシアムメンバーが5年間の研究成果を発表した。
HMPは、NIHの共通基金を、2007年の会計年度開始以来、1億5千3百万ドル受理している。NIH共通基金はインパクトが高く革新的なNIHの共同研究(trans-NIH)に対して助成されるものである。
NIHの各研究機関や各研究センターは、HMPコンソーシアム研究に対する共同助成金として追加で2千万ドルを提供した。
「15世紀の探検家が新大陸の概要を描いたのと同様に、HMPの研究者らは人体の正常微生物構成を初めて示すため、新しい技術戦略を採用しました。
HMPは健常な検体提供者の微生物群を分析するため、ゲノム塩基配列決定技術を用いて画期的な参照データベースを作成しました。
このことは、この共有する情報源を持たなかったために以前は不可能であった感染症研究の加速化への基礎固めをします」と、NIHの所長であるFrancis S. Collins医学博士は述べた。
方法と結果
人体には数兆個の微生物が存在し、その数はヒトの細胞数を圧倒的に上回る。
微生物は非常に小さいため、ヒトの体重の約1~3%であるが(200ポンド(約90キログラム)の成人では細菌群は2~6ポンド(約0.9?2.7キログラム)、ヒトの健康に大きな役割を果たしている。
人間の正常なヒトマイクロバイオームを解明するため、HMPの研究者らは242人の健常米国人(男性129人、女性113人)から検体を採取し、男性15カ所、女性18カ所の身体部位から組織を収集した。
研究者らは
各検体提供者の各身体部位、すなわち口腔、鼻腔、皮膚(両耳の後ろ、両肘内側)、腸管下部(便)、女性の膣内の3カ所から最大で3検体を採取した。
各身体部位にはアマゾンの熱帯雨林とサハラ砂漠に生息する微生物群に匹敵するほど多様な微生物が生息している可能性がある。
従来、医師は患者の微生物群を、病原体を単離し培養することにより検査していた。
微生物群は研究室内で増殖させることが困難であるため、通常は、この骨の折れる作業によってほんのわずかの種類の微生物しか同定することができなかった。
HMPの研究者らは、5000検体以上のヒトと微生物群の各検体の全DNAを精製し、DNA塩基配列決定装置で解析した。
計算機を用いて、
細菌だけにみられる特異的な遺伝信号(
16S rRNAと呼ばれる細菌のリボソームRNAの可変遺伝子)を同定するため、3.5兆塩基対のゲノム配列データを整列(ソート)させた。
細菌のリボソームRNAは、タンパク質を製造する細胞構造の形成を助けるので、様々な種類の微生物群の存在を同定することができる。
この微生物の兆候に注目することで、HMPの研究者らは、ヒトゲノムのDNA塩基配列を解析することなく、細菌のDNAのみを解析することができた。
さらに、
メタゲノミックシークエンシング(あるいは、微生物群の全DNA塩基配列決定)によって、これらの
微生物群の遺伝子にコード化されている代謝活性を解析することができた。
「最近開発された
ゲノム塩基配列決定法は、ヒトマイクロバイオーム研究にいわば強力なレンズを提供した。DNA塩基配列決定にかかる費用が、驚くほど下落したことよって、ヒトマイクロバイオームプロジェクトが、行っているような大規模な研究が、可能になった。」と、NIHに代わって、HMPを管轄する国立ヒトゲノム研究所(NHGRI; National Human Genome Research Institute)所長のEric D. Green医学博士は述べた。
医師らは、以前は、わずか数百種の細菌種しか人体から分離できなかったが、HMPの研究者らは、
人体環境内に、1万種を超える種類の微生物が、存在することを計数できた。
さらに研究者らは、健常成人の全微生物属のうち、81~99%を同定したと見積もっている。
「私達は、ヒトの正常微生物群の多様性の境界を明らかにしました。健常西洋人において、何が正常であるかについて良く理解するとともに、生理学と疾患に関連して、マイクロバイオームがいかに変動するかを学びつつあります。」と、NIHのプログラム調整・企画・戦略イニシアティブ(NIHの共通基金を含む)の部門長James M. Anderson医学博士は語る。
また、これらの微生物によって起こる
多血症では、ヒトの遺伝子が関与する以上に、
多くのヒトの生存に応答する微生物遺伝子群が関与しているとHMPの研究者らは報告した。
ヒトゲノムが、約2万2千種類のタンパク質遺伝子をコード化しているのに対し、ヒトマイクロバイオームは約800万種類の固有のタンパク質遺伝子をコード化しており、ヒト遺伝子数の360倍の数の細菌遺伝子群が関与していると、見積もっている。
この細菌ゲノムの関与は人間の生存に非常に重要である。
例えば腸内細菌群が担う遺伝子群によって、人間は食物を消化し、生体内で合成できない栄養素を吸収することができるのである。
「人間は、食事を消化するために必要なすべての酵素をもっているわけではありません。腸内微生物群はわれわれの食事のタンパク質や脂質、炭水化物の多くを、吸収可能な栄養素に分解します。さらに、微生物群はビタミンや、私たちのゲノムでは生成できない抗炎症物質などの有益な化合物を生成します」とNHGRIのHMPプログラム部長であるLita Proctor博士氏は語る。
抗炎症物質は、腫脹など、疾患に応答する免疫系の一部を制御している物質である。
研究者らは
微生物群の代謝活性の関与のほうが、それらを提供する微生物群の種類よりも重要であることを発見して驚いた。
例えば健康な腸管内では、脂肪の消化を助けるため常に細菌群が必要であるが、この機能を担うのはいつも同じ種類の細菌群であるとは限らないのだ。
「細菌群は互いに代打を務めることができるようなのです。代謝機能があるかどうかが重要なのであって、どの種類の微生物がそれを供給するかではないのです」と、Nature誌のHMP関連論文の1論文で共同筆頭著者になっているハーバード公衆衛生大学院のCurtis Huttenhower博士は述べた。
さらに、
ヒトマイクロバイオームの構成は時間とともに明らかに変化している。
患者が病気になったり抗生物質を服用したりすると、マイクロバイオームの構成する微生物群の種類はあちこちの種類の細菌群が影響を受け、かなり変動する。
しかし最終的に微生物群は、たとえ以前の細菌型の構成ではないにしても平衡状態に戻る。
臨床への応用
NIHは、HMPの中で、マイクロバイオームと疾患の関係を明らかにするために数多くの研究に資金助成を行い、さらに診療結果を含めたPLoSの複数の論文にも資金助成している。
例えばヒューストンのベイラー医科大学の研究者らは妊婦24人と妊娠していない女性60人の膣内のマイクロバイオームの変動を比較したが、膣内のマイクロバイオームは出産準備期において細菌群の種類構成が劇的に変動していた。
その変動は主に種類の多様性減少が特徴であった。
新生児は、細菌のスポンジのようなものである。
無菌である子宮から出た後、自分自身のマイクロバイオームを移入する。
新生児が出産後初めて微生物群に接触することから、膣内のマイクロバイオームが健全な出産の成功に関与していることは驚くにあたらないであろう。
セントルイスのワシントン大学医学部の研究者らは、3歳未満の小児によく認められる原因不明の発熱を有する小児の鼻腔内のマイクロバイオームを解析した。
発熱が認められた小児の鼻腔内検体には、発熱が認められない小児の最大5倍量のウイルスDNAが検出され、その種類はより広範であった。
過去の研究ではウイルスには、その複製に至適の温度範囲が存在することが示されている。発熱は病原性ウイルスに対する生体防御機能の1つであるため、迅速なウイルス定量検査を行うことにより、ウイルスの殺傷効果もないうえ、
子供の健康なマイクロバイオームを傷害してしまう抗生物質による不適切な治療を回避しうる。
これらの研究は、特定疾患におけるマイクロバイオームの機能を研究するためにそれらのデータを用いた最も初期の臨床的研究に含まれている。
NIHは、HMPのデータや技術を用いた多くの医学的研究に対して資金援助をしており、それらはクローン病、潰瘍性大腸炎、食道癌における腸内マイクロバイオームの機能や、乾癬、アトピー性皮膚炎、免疫不全における皮膚マイクロバイオームの機能、妊娠や性遍歴、包茎手術における尿生殖器マイクロバイオームの機能、さらには、小児の腹痛や腸管炎、腸管機能不全における未熟児の重篤状態など、数多くの小児期の障害において果たす機能などについての研究が含まれる。
「ヒトマイクロバイオームプロジェクトにおいて重要なのは、疾患特異的な研究を行うことが可能になることです。
私達は正常な ヒトマイクロバイオームがどのようなものかを理解できたので、マイクロバイオームの変動が疾患とどのように関連するのか、あるいはいかに疾患を引き起こすのかを理解できるでしょう」と、ヒトマイクロバイオーム研究の現状と今後の枠組みに関するNature誌掲載論文の筆頭共著者である、メリーランド州ロックビルのJ・クレイグ・ヴェンター研究所のBarbara Methe博士は語る。
NIHの共通基金は、マイクロバイオーム研究の倫理的、法的、社会的意義を評価する一連の研究に対しても資金援助している。
これらの研究成果はまだ発表されていないが、数多くの重要な問題がすでに明らかになっている。
それらには、人体に有用であると考えられる生きた微生物を含んだプロバイオティック製品などのマイクロバイオームを使用する製品群をどのように規制するかという問題から、どの人が健康な時にマイクロバイオーム蓄積を考慮し始める必要があるかという問題まで含まれる。
NIHが2007年12月にHMPを開始したのち、NIHを含む研究助成機関やヒトマイクロバイオームの研究に関心を持つ世界中の研究者らを代表して国際ヒトマイクロバイオームコンソーシアムが2008年に設立された。
コンソーシアムは研究の重複を避け、分子生物学的データや臨床的データを迅速に公表するために研究の調整を行っている。
さらに共通データの品質基準や、研究結果を共有するためのツールを開発も行った。
他の大規模共同研究と同様に、NIHは研究者が、国立医学図書館の一部である国立生物工学情報センターや、HMP
データ解析およびコーディネートセンターなどの公的データベースを通じてHMPデータに自由にアクセスできるようになっている。
ヒトマイクロバイオームプロジェクトは、NIHの一機関であるNIH所長室(NIH Office of the Director)、米国国立アレルギー・感染症研究所(NIAID; National Institute of Allergy and Infectious Diseases)、米国国立関節炎・骨格筋・皮膚疾患研究所(NIAMS; National Institute of Arthritis and Musculoskeletal and Skin Diseases )、米国国立癌研究所(NCI; National Cancer Institute)、米国国立歯科・頭蓋顔面研究所(NIDCR; National Institute of Dental and Craniofacial Research)、米国国立糖尿病・消化器・腎疾病研究所(NIDDK; National Institute of Diabetes and Digestive and Kidney Diseases)との共同事業により、国立ヒトゲノム研究所(NHGRI; National Human Genome Research Institute)が管轄している。
日本に於けるヒトマイクロバイオーム(ヒト常在細菌叢)の研究
第16 回腸内細菌学会(神戸開催)2012年6月15日
シンポジュウム「ヒト常在細菌叢研究の新しい道標」案内より
東京大学大学院新領域創成科学研究科 教授 服部正平
2008年に、国際ヒトマイクロバイオーム計画が開始され、今日までに、わずか
4門の菌種が
ヒト常在細菌叢の大部分を占めること、病態細菌叢と健常者の細菌叢が有意に異なること、ヒト腸内細菌叢が3つの
エンテロタイプに分類できること、食習慣との関連を示した。
日本人腸内細菌叢に特徴的に存在する水生植物の多糖類分解酵素遺伝子、約300万の細菌遺伝子を特定した大規模な腸内細菌叢のメタゲノム解析、法医学分野における個人鑑定への利用の可能性、600株以上のヒト常在菌ゲノム情報の公表等、全体像の解明と研究基盤のリソース整備が進められている。
演者らは,2007年に我が国で最初(世界で2番目)の日本人の腸内細菌叢のメタゲノム解析を発表し、特徴的な315種類の遺伝子の発見や食事と細菌叢機能の関連性、個人間の多様性等を明らかにした。
また、公表した約66万個の腸内細菌遺伝子データは上記のエンテロタイプや
日本人細菌叢に特徴的な遺伝子の発見につながった。
また,疾患との関連についても進展がある。
腸内細菌叢が炎症性腸疾患の発症要因であることは以前より知られているが、最近では、1型糖尿病、多発性硬化症、肥満、メタボリック症候群、動脈硬化症等の消化管以外の様々な臓器/組織を冒す疾病の発症に関係することも示され、腸内細菌の異常が全身的な疾患発症の根幹に存在するという考えが今日浸透して来ている。
個々の常在菌の機能に関する研究も進められている。
たとえば、
常在菌プロテアーゼによる免疫細胞Th17の誘導と大腸がんの促進、常在菌ATPによる炎症応答の亢進、セグメント細菌(SFB)によるTh17細胞の誘導、クロストリジウム属によるTreg細胞の誘導、ビフィズス菌の酢酸による大腸菌O157感染死の防御等、常在菌の対宿主作用が遺伝子・細胞レベルで明らかにされて来ている。
とくに興味深い知見は、
肥満やメタボリック症候群マウスの腸内細菌叢が遺伝的に健康なマウスに同じ疾患を発症すること。
また,
SFBやクロストリジウム属といった特定の菌種が宿主の遺伝的背景に関係なくT細胞分化を誘導すると言う事実である。
これらの事実は、腸内細菌が宿主に対する独立した作用因子であることを強く示唆するものである。
腸内細菌叢に関する論文(2006-2011年 Nature)
腸内細菌の多糖類代謝能力が肥満に直接関係する。
An obesity-associated gut microbiome with increased capacity for energy harvest
Turnbaugh PJ et al. Nature 444, 1027-1031 (2006)
腸内常在菌Bacteroides fragilisの生産する多糖類が炎症反応を抑制する。
A microbial symbiosis factor prevents intestinal inflammatory disease
Mazmanian SK et al. Nature 453, 620-625 (2008)
腸内細菌叢の生産するATPが炎症応答の引き金となる。
ATP drives lamina propria TH17 cell differentiation
Atarashi K et al. Nature 455, 808-812 (2008)
腸内常在菌Bacteroides fragilisが生産するプロテアーゼが大腸がんを促進する。
A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cellresponses
Wu S et al. Nature Med. 15, 1016-1022 (2009)
SFB(segmented filamentous bacteria)がTh17細胞を誘導し、炎症及び抗菌性物質の遺伝子発現を増強する(病原菌の感染を抑える)。
Induction of Intestinal Th17 Cells by Segmented Filamentous Bacteria
Ivanov II et al. Cell 139, 485-498 (2009)
クロストリジウム属46種(スポア形成、クロロホルム耐性、グラム陽性細菌)の細菌叢が大腸におけるTreg細胞の誘導に不可欠である。
Induction of Colonic Regulatory T Cells by Indigenous Clostridium Species
Atarashi K et al. Science 331, 337-341 (2011)
ビフィズス菌の生産する酢酸がO157による感染死を防御するー糖トランスポーターの重要性ー
Bifidobacteria can protect from enteropathogenic infection through production of acetateFukuda S et a. Nature 469, 543-547 (2011)
腸内細菌叢とその構成
ヒトや動物の腸は、摂取した食餌を分解し吸収するための器官であるため、生物が生育するのに必要な栄養分が豊富な環境です。
このため、体表面や泌尿生殖器などと比較して、腸内は種類と数の両方で、最も常在細菌が多い部位です
。
この多様な細菌群は、消化管内部で生存競争を繰り広げ、互いに排除したり、共生関係を築きながら、一定のバランスが保たれた均衡状態にある生態系が作られます。
このようにして作られた生態系を
腸内細菌叢と呼びます。
ヒトや動物が摂取した食餌は、口、食道、胃を経て、十二指腸などの小腸上部に到達し、その後、宿主に栄養分を吸収されながら、大腸、直腸へと送り出されます。
このため、消化管の場所によって、その内容物に含まれる栄養分には違いが生じます。
また消化管に送り込まれる酸素濃度が元々高くないのに加えて、腸管上部に生息する腸内細菌が呼吸することで酸素を消費するため、下部に進むほど腸管内の酸素濃度は低下し、大腸に至るころにはほとんど完全に嫌気性の環境になります。
このように同じ宿主の腸管内でも、その部位によって栄養や酸素環境が異なるため、腸内細菌叢を構成する細菌の種類と比率は、その部位によって異なります。
一般に小腸の上部では腸内細菌の数は少なく、呼吸と発酵の両方を行う通性嫌気性菌の占める割合が高いが、下部に向かうにつれて細菌数が増加し、また同時に酸素のない環境に特化した偏性嫌気性菌が主流になります。
また、
胆汁酸が界面活性剤として細菌の細胞膜を溶解する作用により小腸内や胆管での腸内細菌叢の形成を妨げています。
毎日、合計で20-30gの胆汁酸が腸内に分泌され、分泌される胆汁酸の90%は回腸で能動輸送され再吸収され再利用され、腸管から肝臓や胆嚢に抱合胆汁酸が移動することを、腸肝循環と呼んでいます。
殺菌作用のある胆汁酸が回腸でほとんど吸収されるため、
腸内細菌は回腸以降の大腸を主な活動場所としています。
消化管の部位の違いによるヒト腸内細菌の数(内容物1gあたり)はおよそ以下の通りであります。
糞便に排出される菌の組成は、大腸のものに類似しています。
小腸上部: 内容物1gあたり約1万個。
Lactobacillus属、
Streptococcus属、
Veionella属、
酵母など。
好気性、通性嫌気性のものも多い。
小腸下部: 1gあたり10万-1,000万個。
小腸上部の細菌に大腸由来の
偏性嫌気性菌が混在。
大腸: 1gあたり100億-1,000億個。
ほとんどが
Bacteroides、
Eubacterium、
Bifidobacterium、
Clostridiumなどの
偏性嫌気性菌。
小腸上部由来の菌は1万-100万個程度。
これらの腸内細菌の組成には個人差が大きく、ヒトはそれぞれ自分だけの細菌叢を持っていると言われています。
ただしその組成は不変ではなく、食餌内容や加齢など、宿主であるヒトのさまざまな変化によって細菌叢の組成もまた変化します。
遺伝子機能は人によらず共通しています
メタゲノム解析からは腸内細菌叢がコードする遺伝子の全体像も見えてきました。
興味深いことに、大人の腸内細菌叢を構成する菌の種類は個人差が大きいにもかかわらず、その遺伝子組成は人によらずほぼ同じであるという結果が得られました。
つまり、
体内の菌の種類が異なっていても、全体としての機能はどの人にも共通しているのです。
この結果は、腸内細菌叢を構成する細菌はそれらが有する遺伝子(二機能)によって選択されてきたことを意味しています。
ヒト腸内細菌叢に顕著に豊富な遺伝子の典型として
糖類の吸収や分解に関わる遺伝子群があります。
ヒトが消化できない、主に植物由来の糖類がこれらの遺伝子の働きによって取り込まれ、または分解されて細菌自身のエネルギー源となり、その代謝物であるビタミン類や酢酸などの短鎖脂肪酸がヒト細胞に栄養素として供給されます。
この糖類の吸収と分解にかかわる遺伝子群を大人と乳児で比較すると、乳児には
単糖類や
アミノ酸などの低分子の取り込みに働く遺伝子を持つ菌種が、大人では
多糖類を分解する遺伝子を持つ菌種がそれぞれ多くなります。
この違いは、両者の食事の違いに関係します。
離乳前の乳児の食事は、単糖類やアミノ酸などの低分子の物質を主成分とする母乳ないしは人工乳ですが、大人の通常の食事には多糖類が多く含まれます。
つまり、食事成分が細菌叢の遺伝子レパートリーに大きく影響するのです。
一方、腸内細菌叢には、鞭毛や化学走化性など細菌の運動性に関わる遺伝子群が、人体以外の環境細菌叢に比べて顕著に少ないという特徴があります。
これは、腸管内では細菌のエネルギー源である食事成分は、腸の蠕動(ぜんどう)運動(うんどう)で移動してくるので、細菌は運動性を必ずしも必要としないことによるようです。
多くの常在菌が鞭毛を持たないことで、鞭毛を抗原とした宿主の免疫応答の始動が回避されるという利点もあります。
免疫応答は、異物の侵入に対する宿主側の防御機構のひとつであり、その多くが鞭毛を有する病原菌はこの免疫応答により感知されます。
こうした腸内細菌の様々な特徴は、ヒト腸管環境で有利に生存するための適応進化の結果と捉えることができます。
以上のように、
ヒトは腸管内で他者である細菌に餌とすみかを与え、その代わりに細菌の力を借りてヒト自身が消化できない食事成分(多くは植物由来の糖類)からビタミン類などの栄養素やエネルギー源を獲得するという相互扶助関係が成立しています。
通常、生物は新たな機能を長い進化を経て自身の既存の遺伝子やゲノムの重複などから獲得します。
こうした時間のかかる方法ではなくて、他者である腸内細菌のゲノムを手っ取り早く取り込むという戦略を選ぶことで、自身の生存に有利な食・エネルギー源の拡大と向上に成功したといえます。
腸内細菌と病気
細菌叢の中で、病気との関係が最も研究されているのは腸内細菌叢です。
消化管のなかでも小腸と大腸は免疫系と密接に関係しており、全身の免疫細胞の約60%が腸管周辺に存在するといわれています。
免疫不全の無菌マウスは炎症を起こさないが、腸内細菌が存在すると炎症が起こる事例がこれまで多数報告されています。
一方、免疫系が健全な場合は腸内細菌の有無にかかわらず炎症は起こりません。
このことは
炎症の発症には宿主の免疫異常と腸内細菌の両方が必要であることを意味します。
ヒトは通常無菌状態ではないので、
炎症は一見して宿主の異常に100%依存しているようにみえます。>
しかしながら、最近の研究では、宿主の状態に関係なく腸内細菌そのものが病気発症の直接の要因である場合があることを示すデータが蓄積されています。
ヒトの例ではないが、肥満遺伝子(肥満を防ぐ遺伝子)をノックアウトしたマウスは、肥満となるが、その肥満マウスの腸内細菌叢を遺伝的に健全な無菌マウスに移植するとそのマウスも肥満を発症する。
同様に、細胞表面にあり、病原体を感知して自然免疫を作動させる機能を持つ
To11様受容体5(TLR5)の遺伝子をノックアウトして生じたメタボリック症マウスの腸内細菌叢を、遺伝的に健全な無菌マウスに移植すると、メタボリック症になった。
肥満マウスやメタボリック症マウスの腸内細菌叢は健康なマウスの腸内細菌叢とは、統計的に有意に異なっている。
ヒトにおいても肥満の人の腸内細菌叢は、健康な人の腸内細菌叢と異なっている。
肥満の腸内細菌叢では
フィルミクテス門が健常者よりも多い。
フィルミクテス門は、これとトレードオフの関係にある
バクテロイデス門に比べて糖類を代謝する遺伝子を多く持つ菌種が多い。
このため、同じカロリーの食事をとってもその高い糖類代謝能によって脂肪の蓄積が増加すると説明されている。
事実、低糖類の食事でダイエットに成功した人たちのフィルミクテス門は、肥満時よりも減少し(同時にバクテロイデーテス門が増え)、健常者と同等の菌種組成に変化する。
近年、宿主の免疫系に働く細菌種の特定も進んでいる。
例えば、
Th17と呼ばれる分化T細胞の分化誘導に、
セグメント細菌(SFB)という常在菌が関与していることが2009年に報告された。
Th17は、感染防御や自己免疫疾患に関係したT細胞として近年注目されている。
2010年には自己免疫疾患を抑制する機能を持つ制御性T細胞の誘導に関係するバクテロイデス・フラジリスが、2011年には同様に、この制御性細胞を誘導するクロストリジウム属が発見された。
将来的に、これらの宿主に作用する常在菌をコントロールすることによって病気の症状を和らげ、あるいは治療する方法が開発できるかもしれない。
このほかにも病気に関係した細菌種が特定され始めている。
腸内細菌叢が
アレルギー、動脈硬化、糖尿病、多発性硬化症など消化管以外の遠隔臓器を冒す疾病の発症につながることが明らかになり、腸内細菌異常が病気の根幹に存在し、腸内細菌が宿主全身の恒常性の維持と破綻に大きく関与する考えが浸透してきている。
しかし、1000菌種を超える複雑な腸内細菌叢から病気に関与する菌種を精度高く見つけるには、より定量性の高い解析法の開発と統計学上の有意差を示すための多数のサンプル解析が必要になる。
さらには、より詳細な検証には腸内の代謝物(
メタボローム)や宿主細胞の遺伝子発現(
トランスクリプトーム)などの広範囲な分子情報(
オーミクスデータ)も必要になる。
細菌叢(ヒトマイクロバイオーム)とがん(癌)
フソバクテリウム・ヌクレアタム(Fusobacterium nucleatum)と呼ばれる一般的な口内細菌による感染が
結腸直腸がんの一因となる可能性があることが、米ケース・ウェスタン・リザーブ大学歯科医学部歯周病学教授のYiping Han氏らの研究で示唆された。
研究論文は、「Cell Host & Microbe」2013年8月14日号に掲載された。
2008年5月27日に
歯周病とがんに関連性がある事が発表されました。
様々な病気と関連のある歯周病!これまでにも歯周病と肺炎・歯周病と骨粗鬆症・歯周病と糖尿病・歯周病と心筋梗塞・歯周病と早産・歯周病とメタボリックシンドロームと報告されていました。
今回、歯周病によりがんのリスクが高まる可能性があるとの研究結果が明らかになりました。
インペリアル・カレッジ・ロンドンのドミニク・ミショー博士らが専門誌に発表されたのです。
歯周病歴のある男性医療専門家を対象にした長期研究で、がんを患う可能性が全体的に14%高いことが判明しました。
論文では「喫煙その他のリスク要因を考慮した上でも、
歯周病は肺や腎臓、すい臓、血液のがんのリスク増大と大きな関連性があった」と報告されています。
腸に住んでいるある平凡な細菌によって大腸がんは引き起こされる!
論文Janelle C. Arthur/Science. 2012 Oct 5
ヒトの腸内には100兆個もの細菌が存在しており、腸内で細菌同士が互いに協力し、腸内細菌叢とよばれるネットワークを形成して生息しています。そのネットワーク形成には細菌だけではなく、細菌と宿主であるヒトの腸管の細胞や免疫細胞とのつながりも重要になっています。たとえば、ヒトの年齢や食事、体調によっても腸内細菌叢は変化し、そのバランスが崩れた場合には病気の原因にもなったりします。
腸管内では常に細菌とヒトの細胞とは接触しており、免疫反応など様々な反応が起きています。免疫反応としての炎症は自らの体を細菌やウイルスから防御するために引き起こされますが、その炎症反応ががんの発症にも関わっていることが明らかになっています。
様々な研究により、いくつかのがん、特に大腸がんにおいて
慢性炎症が危険因子として知られています。これまで、炎症細胞とそれらの細胞から産生される炎症性サイトカインや活性酸素などが大腸がんの発生に関わっているのではないかと考えられてきました。しかしながら、今までは慢性炎症と大腸がんを結びつけるものははっきりとは理解されていませんでした。今回、筆者たちは
「がん」と「炎症」と「腸内細菌」の3つに着目して、慢性炎症によって腸内細菌叢のバランスが崩れ、ある特定の細菌が増殖することで、その細菌によって産生される因子が大腸がんの発生を引き起こしていることを明らかにしました。
「マイクロバイオームと疾患」 246巻13号
2013年9月28日 p.1095-1101
大谷直子・原英二 がん研究会がん研究所生物部 科学技術振興機構さきがけ
科学技術振興機構CREST
近年、ヒトと共生する腸内細菌の変化がさまざまな病態に関与することが明らかになってきた。
しかも、腸内細菌の影響はその代謝物の吸収・輸送により肝など遠隔臓器にも及ぶ、今回著者らは、肥満により変化した腸内細菌が産生する代謝物、デオキシコール酸(DCA)が腸肝循環によって肝に到達し、肝がんの発症を促進することを明らかにした。
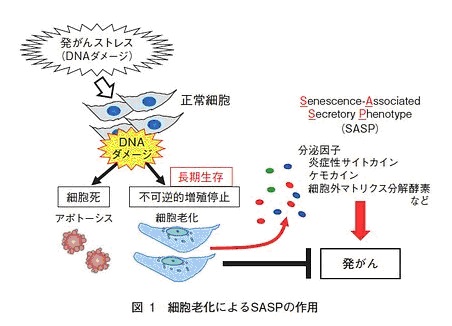
その分子メカニズムとして、肝に到達したDCAが肝の間質に存在する肝星細胞にDNAダメージを与え、細胞老化(「図1参照)を起こし、それに伴う
SASP(senescence-associated secretory phenotype)と呼ばれる現象によって産生される炎症性サイトカインが、周囲の肝実質細胞の発がんを促進することを見出した。
実際にDCAの産生を阻害したり、腸内細菌を死滅させると、肥満による肝がん発症が著しく減少した。
これらのことから、DCAにより肝星細胞がSASPを起こすことが肥満による肝がんの発症に重要な役割を担っていることが明らかになった。
さらに、肝星細胞におけるSASPの誘導はヒトの非アルコール性脂肪性肝炎(non-alcoholic steatohepatitis:NASH)を素地とする肝がん患者の肝がん部においても検出され、ヒトにおいてもマウスと同様のメカニズムが働いている可能性が示唆された。