がん遺伝子と癌抑制遺伝子
私たちの体は約60兆個の細胞(平均体重60kg)でできています。
「がん」はこれらの正常な細胞が化学物質やウイルス、放射線、紫外線等の発がん因子、慢性炎症などが原因で
DNAが傷つき変異を起こして細胞分裂のコントロール(細胞周期)が効かなくなり 勝手に増え続けてしまう病気です。
がんの発生は、よく車のアクセルとブレーキに例えられます。
がん遺伝子と呼ばれる細胞のがん化を進める遺伝子(アクセル役)と
がん抑制遺伝子と呼ばれる細胞のがん化をとめる遺伝子(ブレーキ役)とがあり、どちらに
異常が起きても細胞増殖のコントロールができなくなることで「がん」が発生することが明らかになりました。
がん遺伝子というとがんを作る悪いイメージがありますが、正常な細胞が分裂をするために必要な遺伝子であり、一方のがん抑制遺伝子は細胞が増殖する働きにブレーキをかける役割を持っています。
がん遺伝子とがん抑制遺伝子はバランスが取れている必要があるのです。
正常細胞は絶えず分裂を繰り返し新しい細胞に生まれ変わります(新陳代謝)。
通常は発癌因子などで遺伝子が傷つけられても修復されますが、恒常的に遺伝子が傷つけられるようになったり遺伝子の修復機能の働きが悪くなったり、
遺伝子の異常を見つけることができなくなると正常な細胞ががん化していきます。
遺伝子が傷つく危険性を少なくすることががん予防に役立つのです。
遺伝子・DNA・染色体・ゲノムとは
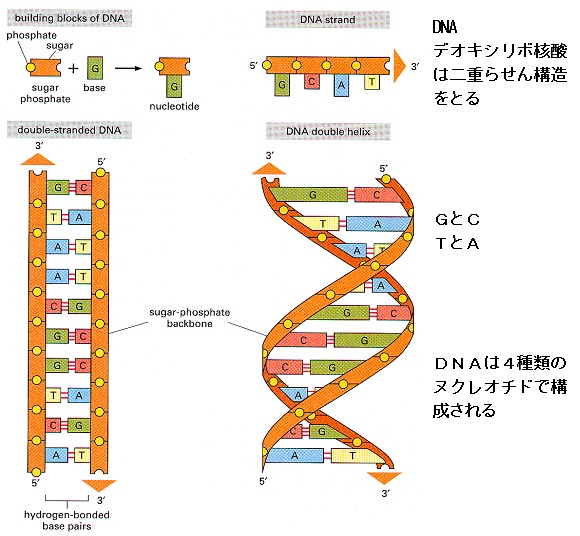
遺伝子は、タンパク質の構造にかかわる暗号部分と、その暗号の読み取りを指令する部分を
デオキシリボ核酸(DNA)の二本鎖分子の中に情報を蓄えています。
DNA鎖を構成する単量体、つまり
ヌクレオチドは2つの部分からなっています。
リン酸基のついた糖(デオキシリボース)と、
アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)のいずれかの塩基(糖は必ずリン酸基を介して次の糖とつながっている)です。そして、AはTとのみ、GはCとのみ結合します。
従って、2本の鎖の結合部は必ずその2種類の塩基の組み合わせになっています。
この塩基の並び方が遺伝暗号になっており、DNAの中で遺伝暗号をもっている遺伝子といわれる部分は約21700個、塩基対が約30億個と言われています。
DNAは、その情報を用いて転写によりリボ核酸(RNA)を合成し、翻訳により筋肉や体内でいろいろな働きをする酵素やホルモンなどの、さまざまなタンパク質が作られていきます。
 動物細胞の模式図:
動物細胞の模式図:
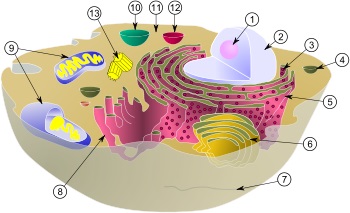
| (1) 核小体(仁) | (8) 滑面小胞体 |
| (2) 細胞核 | (9) ミトコンドリア |
| (3) リボソーム | (10) 液胞 |
| (4) 小胞 | (11) 細胞質基質 |
| (5) 粗面小胞体 | (12) リソソーム |
| (6) ゴルジ体 | (13) 中心体 |
| (7) 微小管 | |
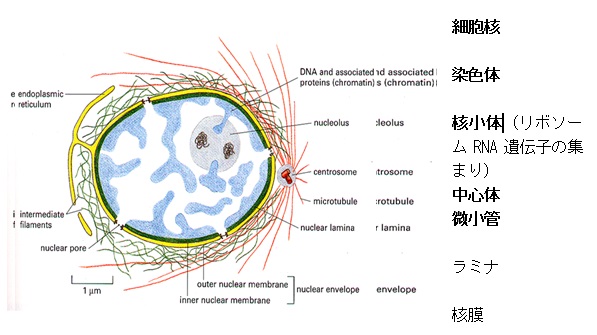
染色体
細胞核の中にある染色体は、ヒストンと呼ばれるタンパク質にDNAが巻き付いた棒状の固まりです。
染色体は通常は核の内部でほどけていて、
細胞分裂のときがくると、棒状のはっきりとした姿を現します。
ヒトの場合、一つの細胞の中に22対の常染色体と1対の性染色体が現れるのですが、性染色体は女性では2本のX染色体なのに対し、男性ではX染色体とY染色体と、異なる染色体になっています。このことから、Y染色体が性別を決めるカギを握っていると考えられています。
常染色体と性染色体の中に入っている全てのDNAをヒトのゲノム言います。
染色体は細胞周期に応じて異なった状態で存在します(細胞周期参照)
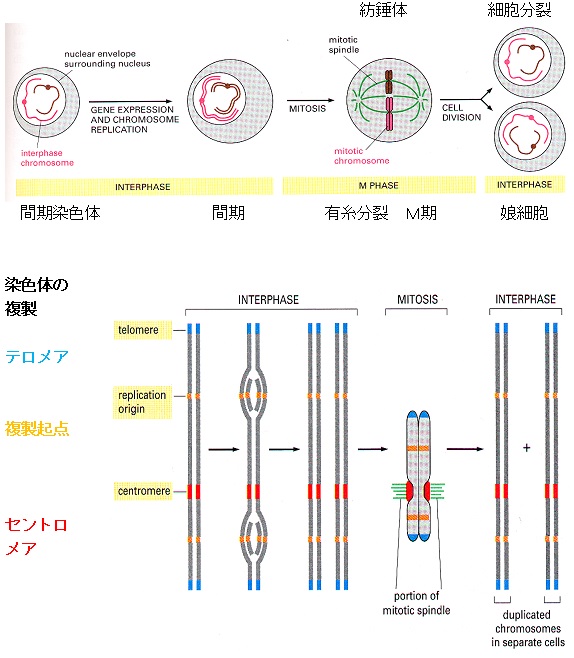
細胞分裂に伴う染色体(chromosome) の変化
DNAは細胞分裂のたびに複製され、できたコピーは2個の娘細胞にきちんと分配されなければなりません。
テロメア
テロメア(Telomere) はギリシア語で「末端」を意味します。
テロメアはその特異な構造により、DNAの分解や修復から染色体を保護し、物理的および遺伝的な安定性を保つ働きと細胞分裂における染色体の正常な分配に必要とされています。
テロメアを欠いた染色体は、細胞によって異常なDNA末端と見なされ、酵素による分解や、修復機構による染色体末端どうしの異常な融合が起こります。
このような
染色体の不安定化は細胞死や発がんの原因となるのです。
テロメアの伸長はテロメラーゼと呼ばれる酵素によって行われますが、この酵素がない細胞では、細胞分裂のたびにテロメアが短くなります。
テロメラーゼはヒトの体細胞では発現していないか、弱い活性しかもたないので、
テロメアが一定長より短くなると不可逆的に増殖を止め、細胞老化と呼ばれる状態になります。
細胞老化は細胞分裂を止めることで、前述のようなテロメア欠失による染色体の不安定化が起こることを阻止し、発がんなどから細胞を守る働きがあると考えられています。
テロメアのゲノムDNAは二本鎖からなる二重らせん構造をしていますが、テロメアの最末端部位ではDNAの3'末端が突出(オーバーハング)して一本鎖になっていて、特徴的な反復配列(テロメアDNA)とそこに局在する種々のタンパク質からなっています。
テロメアの細胞老化と不死化、がん化への関与
テロメアやテロメラーゼは、細胞の老化や不死化と呼ばれる現象に重要な役割を担っており、これを介して生体の恒常性維持やがん化とも密接に関連していると考えられています。
細胞は、一定数の分裂を行うと細胞周期が停止してそれ以上は分裂できなくなります。
この現象を細胞老化と呼びます。
これに対して、
がん化した細胞などは際限なく分裂することが可能であり、この形質を
細胞の不死化と呼びます。
ここでいう
「不死」とはその細胞自体が死なないという意味ではなく、
細胞が分裂の永続性を獲得しているという意味です。
ゲノムの安定性という点から考えると、老化と不死化は相反する現象ということができる。
つまり不安定になったゲノムは老化によって不安定化を抑制することや、一時的に老化状態にすることで修復する猶予を与える仕組みを備えており、
がん細胞のような不死化細胞はそれらの監視機構を逃れた状態にあると言えます。
ここに
テロメアやテロメラーゼが大きく関与していると考えられているのです。
細胞のがん化には、(1) 増殖能の亢進、(2) 不死化、(3) アポトーシスからの回避、の三段階の変化が生じることが必須であると考えられています。
テロメアとテロメラーゼは細胞老化と不死化を制御することによって、がんの発生にも関与していると考えられています。
テロメラーゼによるテロメアの伸長修復は、染色体を維持することで、永続的な細胞分裂、つまり細胞の不死化に重要な役割を担っています。
マウスの細胞はテロメラーゼ活性が高いため、細胞周期やDNA損傷を監視して
細胞老化に導p53やRbタンパク質を抑制するだけで、容易に不死化させることができます。
またヒトの細胞でも、それらの抑制に加えてテロメラーゼを導入することで不死化させることが可能です。
このようにテロメラーゼ活性の亢進などによって、テロメア長が維持されていることが細胞の不死化の必要条件の一つです。
形質転換(がん化)したヒトのがん細胞の9割近くでテロメラーゼの再活性化(不死化)が報告されています。
がんが悪性である最大の理由は、染色体不安定性
がんが悪性である最大の理由は、あらゆる治療戦略でがん細胞の除去を試みても、腫瘍は多様な性質を獲得した細胞から構成されるために、がん細胞を残さずに根絶することが難しいからです。
昔から多くのがんはそれを構成するそれぞれの細胞の染色体数が異なる異数性であることが知られ、
がん細胞は、細胞分裂の度に染色体数が変動する染色体不安定性と呼ばれる病態に陥っていると考えられます。
実際に、異数性細胞の出現と臨床的な悪性度とは相関がみられることからも、染色体不安定性の獲得とがん細胞の不均一性とは無関係ではないはずで、
染色体不安定性の究明こそが、がん病態の根幹的な理解につながると考えます。(国立がん研究所 がん細胞における染色体不安定性の発生機構より)
染色体の分配異常は多くのがん細胞において共通にみられる性質のひとつである。
この性質は“染色体不安定性”(chromosomal instability:CIN)とよばれ、
染色体不安定性を示す細胞は染色体の数が増えたり減ったりする“異数性”を示す。
異数性は、がん遺伝子のコピー数の増加やがん抑制遺伝子のコピー数の減少を介し、
細胞のがん化およびがんの悪性化の引き金になると考えられている。
がん細胞における異数性は、いまから1世紀以上もまえに観察され、細胞のがん化における重要なステップになるという概念がそのころから提唱されていた。
そののち長いあいだ、染色体不安定性のひき起こされる原因は謎につつまれていたが、近年になり、分子レベルでの知見が急速に蓄積しその理解は進展している。
細胞分裂における染色体の分配機構の破綻は染色体不安定性をひき起こすもっとも重大な原因となると考えられている。
一般的なヒト培養細胞株における細胞周期は約24時間であるが、このうち、細胞分裂および染色体の分配に要する時間はほんの1時間にもみたない。
この短い時間のなかでダイナミックかつ正確に分配される染色体のふるまいを制御する分子機構は非常に精密で巧妙である。
分配されるべき姉妹染色分体は、分かれるその瞬間まで互いに接着してペアを形成しており、このペアの形成こそが均等な染色体の分配を保障する鍵となる分子機構である。
これまで、この接着の制御機構と染色体不安定性および細胞のがん化との関連はあまり注目されていなかったが、近年の培養細胞および動物個体を用いた研究成果の蓄積により、
染色体の接着制御機構の破綻が染色体不安定性をひき起こすことで細胞のがん化を促進するというモデルが提案された。
ここでは、均等な染色体の分配を保障する分子機構について解説するとともに、姉妹染色分体の接着制御機構の破綻が微小管と動原体との接続の誤りを介して染色体不安定性の引き金となるというモデルについて解説する。
なお、染色体不安定性は、細かくは染色体の数の不安定性(numerical chromosomal instability)と、染色体の構造の不安定性(structural chromosomal instability、遺伝子領域の欠失や重複など)とに分けられるが、ここでは、前者を染色体不安定性として述べる。
(論文:leading.author.1.e004 2012年9月5日 公開 染色体の接着異常とがんSister chromatid cohesion defects and cancer 東京大学分子細胞生物学研究所 染色体動態研究分野 丹野悠司・渡邊嘉典)
本文は、「染色体の接着異常とがん」で検索して下さい。

