骨髄でTリンパ球前駆細胞(T前駆細胞)、胸腺でTリンパ球になる
Tリンパ球は、骨髄において、造血幹細胞 → リンパ系幹細胞 → Tリンパ球前駆細胞へと分化します。
Tリンパ球前駆細胞は、血流に乗って胸腺に到達し、そこでTリンパ球になります。
名前の「T」は胸腺 (thymus) に由来するものです。
胸腺の皮質には未熟なTリンパ球前駆細胞が多く存在し、胸腺の髄質には
成熟したTリンパ球が存在します。
適切に働くTリンパ球(T細胞)のみが選ばれる
骨髄から胸腺に到達したTリンパ球前駆細胞のうち、自分の体を構成している自己成分を認識できない、あるいは自己成分に強く反応してしまう細胞は、その9割以上が除去されると言われています。
すなわち、
自己防衛にとって適切に働くTリンパ球のみが選ばれるわけであり、一般に「Tリンパ球の教育」とよばれます。
この教育は、個体が成熟するまでに完了します。
ヒトの場合、胸腺の中にTリンパ球が最も多く存在するのは10歳代前半であり、ピーク時の胸腺の重さは30~40gです。
胸腺を経たTリンパ球はやがて種々のリンパ器官に運ばれていき、胸腺はその後は急速に萎縮して脂肪組織に置き換わり、それまでに選ばれたTリンパ球のみが骨髄において増産されます。
細胞の表面には、Tリンパ球に特徴的な
T細胞受容体(T cell receptor ;TCR)を備えています。
TCRにはαβ型とγδ型の2種類があり、大部分のTリンパ球はαβ型(=αβT細胞)である。〔αβ型とは、糖タンパク質でできたα鎖とβ鎖がジスルフィド結合(S-S)によって結合した二量体、すなわちαβ鎖をもつ型であり、γδ型とはγ鎖とδ鎖が結合したγδ鎖をもつ型である。これらは、抗体のL鎖によく似ており、定常部(constant region=C領域)と、抗原に直接結合する可変部(variable region=V領域)から成り立っている。本来少ないγδ型Tリンパ球の存在場所は比較的限局しており(皮膚、舌の上皮、腸管上皮、子宮など)、胸腺や二次リンパ組織には少数しか存在しない。〕
ヘルパーTリンパ球は、マクロファージなどから抗原提示があると、インターロイキンやインターフェロンなどの各種のリフォカインを放出し、主に他のリンパ球にそれぞれの役割を果たすように刺激を与えます。
ヘルパーTリンパ球(ヘルパーT細胞)は、細胞の表面にCD4と名付けられた分子を持っているので、
CD4陽性Tリンパ球とも呼ばれています。
このCD4陽性Tリンパ球はヒト免疫不全ウイルス(HIV) や、ヒトT細胞白血病ウイルス (HTLV-1) が感染する細胞です。
このヘルパーTリンパ球は、その産生するリフォカインの種類によって、さらに次のように分類されています。
| Th1(細胞性免疫) | IL-2(インターロイキン2)、IFN-γ(インターフェロンγ)、TNFα(腫瘍壊死因子)などを産生する。これらよって、Tリンパ球の増殖や分化、マクロファージ、NK細胞、細胞傷害性Tリンパ球が活性化される。
|
| Th2(液性免疫) | IL-4、IL-5、IL-13などを産生する。
これによって、主にBリンパ球の増殖・分化や抗体産生が促され、
マクロファージからの炎症性サイトカインの産生が促進される。
|
| Th17 | IL-17などを産生する。これによって、炎症が促進される。
また、自己免疫疾患との関わりが報告されている。
|
細胞傷害性Tリンパ球(キラーT細胞)は標的細胞の自滅を誘う
かつてはキラーT細胞と呼ばれましたが、今は
細胞傷害性T細胞(cytotoxic T lymphocyte)と呼ばれ、
略号としてはTc、あるいはCTLが用いられています。
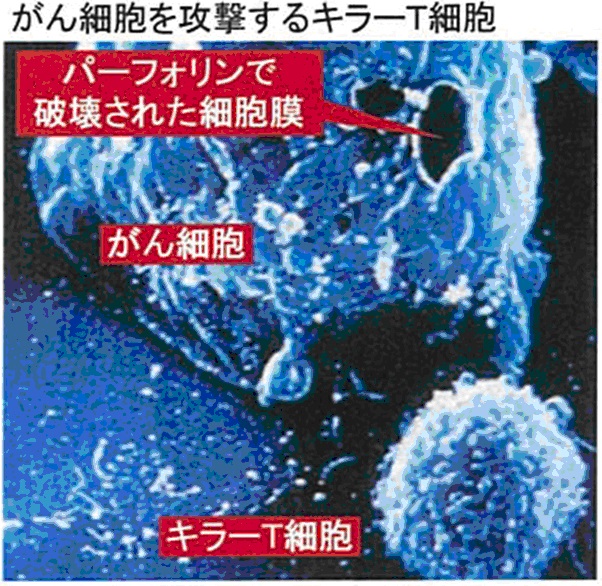
宿主にとって異物となる細胞(癌細胞、移植細胞、ウイルス感染細胞など)を認識して消滅させる。
細胞に傷害を与えるメカニズムは次のようである
CTLは、パーフォリン(perforin)、およびグランザイム(granzyme)と呼ばれるタンパク質を分泌する。
↓
パーフォリンは異物となる細胞の細胞膜でリング状の重合体(polyperforin)を形成することで、細胞膜に孔を開ける。(CTL自身はパーフォリンが効かないような機構を備えている。)
↓
グランザイムがこの孔から異物細胞内に侵入する。
グランザイムは標的とする細胞にアポトーシスを起こさせ細胞を消滅させる。
CD8陽性Tリンパ球(CTL)は、細胞の表面にCD8と名付けられた分子を持っており、CTLの一部は
メモリーTリンパ球となって、異物に対する細胞傷害活性を持ったまま体内に保存され同じ抗原が再び現れた時に短時間で増殖します。
レギュラトリーTリンパ球、その細胞表面に CD4、CD25(制御性)、およびFoxp3(転写因子)といわれる分子を発現するTリンパ球の存在が言われており、これは他のTリンパ球の活性を抑制するというので、レギュラトリーTリンパ球(
制御性T細胞)と呼ばれています。(かつてはサプレッサーTリンパ球と呼ばれた時期がありました。)
レギュラトリーTリンパ球が、例えば癌細胞の周囲を取り囲んでしまうと、細胞傷害性Tリンパ球が攻撃できなくなり、
癌細胞は増殖を続けるという構図になります。
胸腺を介さずに分化成熟する
末梢性Tリンパ球。
NK細胞とTリンパ球の性質を併せ持つNKTリンパ球が注目を集めている
免疫系を構成するリンパ球は、これまで
胸腺で分化するT 細胞、抗体を産生するB 細胞、それにナチュラルキラー(NK)細胞と呼ばれる三種類の細胞系列が明らかにされていました。
しかし、新たに発見された第四のリンパ球ともいうべき
NKT 細胞は、自然免疫系と獲得免疫系を繋ぐキーの細胞として注目を集めています。
NKT細胞はTh1サイトカインもTh2サイトカインも分泌し、さらにパーフォリン、グランザイムを作り、標的細胞にアポトーシスを誘導して殺す、したがって、NKT細胞は一人で三役もこなすのです。
このことは、NKT細胞がT細胞よりも進化論的に劣っているとみなすこともできます。
いずれにしても、 NKT細胞が免疫調節系の重要な位置を占めていることは疑いのないことです。
自然免疫系と獲得免疫系の相互作用が存在する証拠でもあります。
NKT細胞は骨髄や肝臓などの胸腺外組織にきわめて多く存在します
NKT細胞が関与する病態はこれまでの予想よりはるかに多く、自己免疫疾患発症制御、 アレルギー調節、抗腫瘍作用、寄生虫感染症制御、流産などに関してはNKT細胞の関与が確定的になっている。
よってこれらの病態、疾病発症機序を再考する必要があることを意味しています。
ナチュラルキラー(NK)細胞は即戦力
ナチュラルキラー(NK)細胞は、他のリンパ球と比較すると形態的には大形であり、
細胞内に顆粒を有し、顆粒の中にはパーフォリンやグランザイムなどを含んでいます。
このような形態は、上記の細胞傷害性Tリンパ球が活性型になったときに似ており、常に細胞傷害活性を持っています。
しかし、T細胞受容体(TCR)やT細胞普遍的マーカーであるCD3(成熟Tリンパ球総数)を持っていないために、Tリンパ球には分類されません。
生まれつき(natural)の細胞傷害性細胞(killer cell)という意味で名付けられ、脾臓や末梢血中に比較的多く存在します。
特に
癌細胞やウイルス感染細胞を除去する場合に威力を発揮しており、いわゆる自然免疫の主因として機能しているリンパ球です。
どのようにして敵か味方かを認識するのかについては、NK細胞は、特有の糖鎖を表面に有する細胞や、細胞表面にMHCクラスI分子を失った細胞を、標的にして傷害するとされている。
MHC(major histocompatibility complex;主要組織適合遺伝子複合体)クラスI分子とは、ほとんどすべての有核細胞と血小板の細胞表面に存在する糖タンパク質であり、内因性抗原を抗原提示する働きをもっている。)
γδT細胞(ガンマデルタT細胞)はCD4+およびCD8+(αβ)T細胞とは対照的に
別のT細胞受容体(TCR)をもち、ヘルパーT細胞、細胞傷害性T細胞、およびNK細胞と同じ性質を共有しています。
また、
腸粘膜における上皮細胞間リンパ球(intraepithelial lymphocutes, IELs)として知られるリンパ球集団の中では多数を占めています。
γδT細胞から応答を得る条件は完全には解明されていません。
他のなじみのない変異型TCR(T細胞受容体)をもったT細胞サブセット(T細胞の一部)、例えば
CD1d-拘束性ナチュラルキラーT細胞(NKT細胞)などと同様に、自然免疫と獲得免疫の間を広くまたいでいます。
一方でγδT細胞は、この細胞はTCR遺伝子を再編成して受容体の多様性を生じること、そして記憶表現型も発達させることができることから、適応免疫の要素です。
他方様々なサブセットは、制限されたTCRあるいはNK受容体が受容体のパターン認識に用いられることがあるため、自然免疫系の一部分をなします。
例えばきわめて多数の
ヒトVγ9/Vδ2 T細胞は
微生物によって産生される共通の分子に対して数時間以内に応答します。
さらに高度に制限されたVδ1+ T細胞は上皮細胞が受けるストレスに応答するようです。
新発見 ヘルパーT細胞がキラー様T細胞へ変化する
2013年1月21日理化学研究所免疫・アレルギー科学総合研究センター(谷口克センター長)免疫転写制御研究グループの谷内一郎グループディレクターと米国のラホイヤアレルギー・免疫研究所(La Jolla Institute for Allergy & Immunology:LIAI)のヒルデ シェルートル(Hilde Cheroutre)教授(免疫・アレルギー科学総合研究センター 環境応答制御研究ユニット ユニットリーダー兼務)らの共同研究グループによる成果です。
病原体による感染症から身体を守り、がん細胞を駆逐するなどの重要な働きを担う免疫応答には、それを調節する司令塔の「T細胞」があります。
T細胞は、大きく「ヘルパーT細胞」と「キラーT細胞」に分けられます。
これら
2種類のT細胞は、胸腺で共通な前駆細胞からそれぞれ分化します。
最近の研究から、
ヘルパーT細胞は、病原体の種類や周りの免疫細胞との関係により細胞の機能を変化できる柔軟性(分化可塑性)を持つことが明らかになってきました。
しかし、これまでの通説では、胸腺での前駆細胞からヘルパー/キラーT細胞への運命決定は不可逆的であり、いったん胸腺でヘルパーT細胞に運命決定された細胞は、その後キラー様T細胞には変化しないと考えられてきました。
共同研究グループは、
腸管で働くT細胞の種類とその機能、分化経路について詳細に解析しました。
その結果、一部のヘルパーT細胞がキラーT細胞と同様の機能を持つキラー様T細胞に機能変化していることを見いだしました。
さらに、その機能変化に必要な遺伝子発現の制御機構を解明しました。
以上発表内容の一部を抜粋

