発がん(癌)の原因は大きく二つに分けられる
一つは老化による場合があります。
年齢を積み重ねながら遺伝子の異常が積み重なって何十年もかかってがん(癌)が出来ると考えられています。
もう一つは年齢には関係なく
食事や喫煙などの生活習慣による場合、ウイルスや細菌、生活環境、遺伝子などが考えられます。
これらは
生体に対し慢性刺激を与え続け過剰に活性酸素を産生させ活性酸素が遺伝子の異常を作り遺伝子異常は異形細胞を生み発がん(癌)につながると考えられます。
がん細胞に対する活性酸素の影響
私たちは生きていくために呼吸をし、酸素を体内に取り入れています。
このとき約2~5%が「活性酸素」になります。
「活性酸素」は殺菌・消毒作用があるので大切な物質なのですが、環境汚染、化学薬品の氾濫、過剰なストレスなどにより体内には過剰な「活性酸素」が発生しやすくなってきています。
生体内でできる過剰な活性酸素を『酸化ストレス』と言います。
酸化ストレスは、生体内で生成する活性酸素群の酸化損傷力と、生体内の抗酸化システムの抗酸化ポテンシャルとの差として定義されています。
活性酸素群は、本来、エネルギー生産、侵入異物攻撃、不要な細胞の処理、細胞情報伝達などに際して生産される有用なものですが、
生体内の抗酸化システム(SOD酵素)で捕捉しきれない
余剰な活性酸素群が生じる場合、
生体の構造や機能を担っている脂質、タンパク質・酵素や、遺伝情報を担う遺伝子DNAを酸化し損傷を与え、生体の構造や機能を乱し、病気を引き起こし、老化が早まり、癌や、生活習慣病になりやすくなります。
(後述遺伝子ミトコンドリアDNA参照)
また、これらの生活習慣病になることで
酸化ストレスが増幅されるという悪循環が起き、さらに疾病・老化が進行することになります。
SOD(スーパーオキシドディスムターゼ (Superoxide dismutase))
スーパーオキシドディスターゼは、スーパーオキシドアニオン(・O2-)を酸素と過酸化水素へ不均化する酸化還元酵素です。
活性中心に銅(Ⅱ)イオンと亜鉛(Ⅱ)イオン(Cu, ZnSOD)、またはマンガン(Ⅲ)イオン(MnSOD)や鉄(Ⅲ) イオン(FeSOD)のように二価または三価の金属イオンを持った酵素で、細胞質(Cu, ZnSOD) やミトコンドリア(MnSOD)に多く局在しています。
酸化ストレスを減少させる役割を持つニッケルイオン酵素(NiSOD)も発見されています。
生成した過酸化水素は、カタラーゼやペルオキシダーゼなどによって分解されます。
がん細胞では活性酸素が高頻度に産生されており、SODの阻害に感受性を示す場合があるため、抗がん剤の標的として研究が行われています。
発がんの引き金は過剰なストレス?
今や二人に一人ががん(癌)になる時代で、がんになる年代も様々です。
何故、発がんされる年代が様々なのか、免疫が落ち細胞が老化してくるとがんになると言われていますが、
若くして発がんした方は、
何故なのか?なぜ、今発がんをしたのか?
何か共通した因果関係はあるのか?
漢方医学療法研究会では、長きにわたり
60歳以下で発がんされたがん患者さんから次のような聞き取りを行ってまいりました。
『がん(癌)発見の1年半前後に大きな精神的ストレスのピークがありましたか?』と言う質問に対し、あったと答えられた方が実に多い事がわかりました。
ストレス度テスト
アメリカ ワシントン医科大学のホームズ博士とレイ博士は人生の出来事からストレスの尺度を作りました。
慢性的なストレス反応はDNA損傷を蓄積します
2011年アメリカデューク大医療センターのM・R・Hara博士らがネイチャー736号に次の様な報告をしています。
ストレス反応は野生動物が自然界で生き残るための重要な反応である。
ところが、文明が発達したゆえに起こるヒトの
精神的なストレスとそれに対する反応は、何ヶ月あるいは何年も継続して起こりうるため身体にはマイナスの影響のあるものと考えられます。
DNA損傷はそういった影響のひとつであると疫学的に示されていましたが、その分子機構はわかっていませんでした。
今回の研究において,Hara博士らは、ストレス反応のひとつである攻撃逃避反応を担うアドレナリン様カテコラミンを持続的に暴露することにより、DNA損傷の蓄積することを示しました。
この
分子機構として、持続的なアドレナリン様カテコラミンによる刺激はβ2アドレナリン受容体を介してβアレスチン1のシグナル伝達によりp53の低下をもたらし、p53の低下がさらにGsタンパク質が引き金となり起こるDNA損傷の蓄積を促進させることを明らかにしました。
DNA損傷が蓄積すると、老化や、腫瘍形成、神経精神症状、流産を助長している可能性があります。
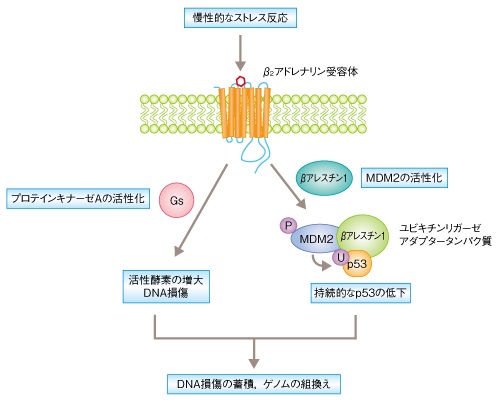
[ 図の説明 ]
慢性的なストレスは長期間にわたるとβ2アドレナリン受容体およびその下流のシグナル伝達の活性化をひき起こす。
Gsタンパク質およびプロテインキナーゼAの活性化はDNA損傷をひき起こす活性酸素を増大させることが知られている。
平常時にはp53による細胞周期の停止のあいだに修復されているDNA損傷も、慢性的なストレス状況においてはβアレスチン1とMDM2による持続したp53の低下をもたらしDNA損傷の修復は滞るものと考えられる。
P:リン酸化,U:ユビキチン化
こうしたGsタンパク質とβアレスチン1による2つのシグナル伝達経路の同調により、β2アドレナリン受容体を介した
慢性的なストレス反応はDNA損傷を蓄積します。
酸化ストレスとメラトニン
メラトニンは脳のほぼ真ん中にある『松果体』と呼ばれる器官から放出されるホルモンです。
メラトニンの原料は、アミノ酸の一種のトリプトファンから4段階の酵素反応を経て生合成されます。
生合成されたメラトニンは細胞内で貯蔵されず速やかに細胞外へと分泌されるため、合成量がそのまま分泌量と相関します。
メラトニンは松果体の他にも、網膜視細胞でもメラトニン合成が行われますが、SCN(視床下部の視交叉上核)由来の時刻情報は用いられず、視細胞内で自律的に振動する概日時計の支配下にあります。
メラトニンは松果体から分泌された後、血液に乗って全身に運ばれ、最終的には肝臓で代謝されます。
唾液や脳脊髄液、卵巣の卵包液、胆汁中にも移行します。
血液脳関門や胎盤も通過します。
メラトニンはヒトの体内時計を調節するホルモンとして知られています。
昼と夜の周期に反応して脳の松果体から分泌され、体の日内リズムを調整しているホルモンで、暗くなると体内のメラトニンの量が増えて眠りを誘います。
メラトニンの合成量が一日の中で変動します。
また、メラトニン合成は概日時計による制御の他に、光環境による制御も受けます。
すなわち、メラトニン合成が活性化する夜間に光を照射すると、メラトニン合成が急速に抑制されます。
夜間におけるメラトニン合成の上昇は、松果体に入力する交感神経終末からのノルアドレナリンの放出が引き金となり開始します。
この終末から放出されたノルアドレナリンは、松果体に存在するβアドレナリン受容体を介して細胞内cAMP(サイクリンAMP)濃度を上昇させ、活性化したPKA(酸解離定数)がCREB(cAMP応答配列結合タンパク)をリン酸化します。
リン酸化されて活性したCREBはAa-nat(アリールアルキルアミンN-アセチルトランスフェラーゼ)遺伝子のプロモーター領域に存在するCREに結合して、Aa-nat遺伝子の転写を活性します。
この結果、松果体におけるAa-nat mRNA量が夜(暗期)の開始から2時間以内に100倍以上に増加し、AA-NATタンパク質の急激な増加を引き起こし、
メラトニンの合成量が急上昇します。
メラトニンには抗酸化作用があり、活性酸素によるダメージから細胞を保護します。
脳細胞の酸化を防ぐことにより、痴呆やアルツハイマー病やパーキンソン病を予防できるのではないかと期待されています。
メラトニンの抗酸化作用は、活性酸素だけでなく、一酸化窒素や過酸化脂質など様々なフリーラジカルを消去できることが特徴です。
毒性の強いヒドロキシラジカルはメラトニンによって効率的に消去され、
不飽和脂肪酸の酸化によって生じるペルオキシラジカルを消去する活性はビタミンEよりも高いことが知られています。
また、
グルタチオンペルオキシダーゼ、スーパーオキシドデスムターゼ、カタラーゼなどの細胞内の抗酸化酵素の活性を高める効果も報告されています。
(病気の起源「がん」 NHKスペシャルより)
癌細胞の共通した特徴
親電子性物質は、環境ストレスを高めます

