癌細胞の性状はその種類によって一様なものではありません。
個々の癌によって表現形質は異なりますが、
以下のような共通した特徴があります。
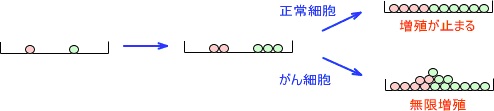
癌細胞は宿主のホメオスタシス(恒常性)から逸脱して無限に増殖し続けます。
1) 実験で正常細胞を癌ウイルスなどで処理すると、細胞は一定の時間経過を経て、 形態の変化などを含む形質転換(癌化)を起こし、無限増殖を始めます。
このような細胞をトランスフォーム(形質転換)細胞という。
トランスフォーム細胞のあるものは、動物に腫瘍を作ることが出来ます。
これは造腫瘍性(腫瘍を形成する能力)と言われ、癌細胞の特徴の1つです。
2) 正常細胞の増殖には、
足場依存性があるが、
癌細胞は足場を必要としない。
従って、軟寒天中に浮遊状態で増殖出来る。
4) 細胞が増殖していくとき、正常な細胞ではお互いに接触すると増殖を抑制しあう性質があります。
これが細胞の接触阻止です。しかし、細胞ががん(癌)化すると接触阻止されなくなります。
つまり、
細胞間同士の増殖制御作用が無効となっているのです。
 自立増殖の意味を例えますと、癌の手術をしたさい、手術した部位周辺に血液がこぼれます。
自立増殖の意味を例えますと、癌の手術をしたさい、手術した部位周辺に血液がこぼれます。
こぼれた血液の中に癌幹細胞が一つでもあった場合、癌の再発が考えられるのです。
高い解糖能
がん細胞では、解糖系の亢進に加えて脂肪酸の新規合成が盛んです
癌細胞で見られる代謝上の特徴の1つは高い解糖能です。
正常細胞では、好気(酸素を必要とする呼吸)条件下で解糖は抑えられるが、癌細胞で好条件下でも高い解糖能を示します。
癌細胞の増殖速度と解糖能の高さとよく相関するので、癌細胞は自らのエネルギー獲得をこの解糖能に依存しています。
癌細胞が高い解糖能を示すのは、解糖系の
律速酵素が正常細胞の酵素とは、別の
アイソザイムに変換されていることに基づいています。
正常細胞はミトコンドリア呼吸(
TCAサイクル)を主として、エネルギー産生を行い、
低酸素の環境においてのみ解糖を利用したエネルギー産生を行います。
一方、
癌細胞は酸素の有無に関係なく解糖系の利用が亢進しています。
この代謝は、
ワールブルグ効果と呼ばれ、
癌の重要な特徴として着目されています。
解糖系の亢進やその側副路である
ペントースリン酸経路の活性化は、細胞内
活性酸素産生の低下につながります。
癌細胞における細胞内活性酸素の低下は、放射線や抗癌剤を使用した癌治療への抵抗性を引き起こします。
癌幹細胞のマーカーでもあるCD44が、腫瘍増殖、癌浸潤・転移に関わるだけでなく、近年、
ワールブルグ効果の制御因子として注目されているビルビン酸キナーゼM2(pyruvate kinase M2 (PKM2)と結合・相互作用することによってその酵素活性を抑制し、
癌細胞における解糖系の利用の亢進を維持していることがわかりました。
さらに、
CD44発現抑制によって起こる解糖系からミトコンドリア呼吸への代謝変調が、グルコース(ブドウ糖)取り込みに必要なグルコーストランスポーター1(GUT1)の発現抑制を誘導することでグルコース取り込みが抑制すること、その結果、解糖系の側副路であり、産生経路でもある
ペントースリン酸経路への流量抑制が起き、還元型
グルタチオン産生減少、
細胞内活性酸素の上昇を引き起こすこと、それが抗癌剤感受性を増強につながることがわかりました。
がんと脂質代謝
がん細胞では不思議なことに、外来性脂質の多寡にかかわらず、
脂肪酸の新規合成が盛んです。
脂肪酸合成酵素(fatty acid synthase: FAS)をはじめ、幾つかの
脂質代謝酵素ががんの発生や悪性化を促進することがすでに知られており、これらががん治療の新たな標的分子となる可能性が期待されています。
但し、その作用機序は明らかでなく、また、これらの酵素を効果的に阻害する手段も未だ十分には確立されていません。
(病気の起源「がん」 NHKスペシャルより)
これまでに、
脂肪酸代謝酵素であるアシル-CoA合成酵素(acyl-CoA synthetase: ACS)が、(1)ミトコンドリア依存的な内因性アポトーシス経路の阻害因子として働き、がんの生存や薬剤耐性に関わり、(2)がん微小環境ストレスのひとつである低pH下において、ミッドカインなどの液性因子の遺伝子・タンパク質発現を誘導し、これによってがん細胞の生存を促進します。
これらのことから、
脂質代謝系ががんの有望な治療標的であることを支持しています。
ACSの阻害は既存の抗がん剤の治療効果を高めることも分かり、現在、その分子機序や他の酵素群(
ATPクエン酸リアーゼ:ATP-citrate lyase:ACLYなど)の関与も調べています。
がん細胞が解糖系を亢進させ脂肪酸を盛んに合成します
左:一般にがん細胞では、グルコース(ブドウ糖)の取り込みおよび分解(解糖)が亢進しています。
これを目印としてがんを早期発見するのが、いわゆるPET診断です。
右:がん細胞では脂肪酸を新しく合成する働きも盛んです。この経路に関わる一連の脂質代謝酵素群は、脂肪酸合成の亢進あるいはそれ以外のメカニズムをも介し、がん細胞の生存と増殖を促していることが判明しつつあります。
グルコース(ブドウ糖)は、解糖系を経てミトコンドリアのクエン酸サイクル(TCA回路)によりエネルギー(ATP)に変換されます。
生成したエネルギーは体が必要とするエネルギーとして利用され消費されますが、その消費量が少ない場合には、グルコースはクエン酸に変換された後、ミトコンドリアを出て脂肪合成の場である細胞質へ移行し、アセチルCoAを経由して脂肪酸そして脂肪、あるいは、コレステロールに変換され、体内に蓄積されます。
アセチルCoAはミトコンドリアを通過できないのですがクエン酸は通過できます。
TCAサイクルでできたクエン酸がミトコンドリアの外に出て、ATPクエン酸リアーゼによって脂肪の合成に使用されるのです。
がん細胞が分裂して細胞を増やすためには、DNAや細胞膜など多くの細胞成分を合成する必要があります。
脂肪も細胞を作るのに必須で、そのため、脂肪合成に重要な酵素であるATPクエン酸リアーゼは、多くのがん細胞で、活性が亢進していることが報告されています。
したがって、
ATPクエン酸リアーゼの阻害は、がん細胞の増殖を抑制する、効果が期待できます。
脱分化・胎児化・異分化は、アイソザイム変換に基くものです
癌細胞においては母細胞の持っていた分化した機能が脱落し、分化機能を担っていた分化型酵素が低下あるいは消失します。(後述体細胞分裂参照)
さらに、分化型酵素に代わって、胎児期に一時的に発現する胎児型酵素が出現したり、別の型のアイソザイム(働きが同等で構造の違う酵素)が出現するなどの
分化の乱れが見られます。
ところで、複数の一次構造の異なる酵素タンパク質が同一種類の反応を触媒するとき、これらの酵素群を
アイソザイムと言います。
アイソザイムはそれぞれ相異なる遺伝子の発現によるものであり、その発現の調節機構も互いに異なっています。
癌細胞で見られる脱分化・胎児化・異分化などの現象も、DNAレベルでの遺伝子発現の変異によるアイソザイム変換に基づくものなのです。
このような
変異の結果、癌細胞ではホルモンや栄養条件などの、 外界の環境変化に即応して機能する分化型酵素が消失し、 自律増殖>に適した代謝を行えるように変化しているとみなすことが出来ます。
アイソザイム変換と同様の現象は、酵素以外のタンパク質でも見られます。
肝癌患者の血中に出現する
胎児性タンパク質、αフェトプロテイン(AFP)もその1つであります。
増殖因子(成長因子)やプロテアーゼ(タンパク質分解酵素)などの分泌
癌細胞からは、いろいろな物質が分泌されています。
ある癌細胞は、
プロテアーゼ(
プラスミノーゲンアクチベーターやコラゲナーゼ等)を分泌。(前述)
これらは癌細胞の浸潤や転移の形成に有利に働くものと考えられます。
癌細胞増殖の驚異のメカニズム 増殖因子と受容体
細胞増殖因子は細胞表面にある細胞増殖因子受容体(レセプター)に取り付きます。
レセプターは細胞の内側で酵素につながっていて、増殖因子を受け取る側と向かい合っているもう一本のレセプターの根元にある酵素を呼び寄せ、レセプター同士を合体(カップリング)させます。
それぞれの酵素は、お互いのタンパク質に働きかけ、触媒反応でそれをリン酸化(チロシンリン酸化)します。
すると、細胞内にあった様々なタンパク質が、それを目印に集まり、増殖因子による情報(シグナル)が次々とリレーされます。
そして細胞の運命を決定する役割を持つ
Ras(ラス)というタンパク質が活性化する(分子スイッチ)と、増殖プログラムを呼び覚ます情報が細胞膜から細胞内へと伝えられます。
最終的には核の中にまで伝えられて、様々な遺伝子を発現させ、細胞が増殖します。
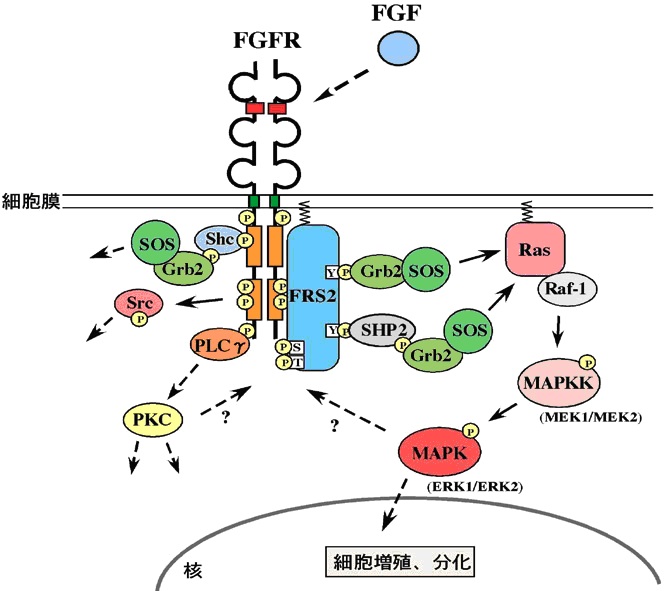 FGF受容体からのシグナル(詳細は、後述の細胞周期を参照してください)
FGF受容体からのシグナル(詳細は、後述の細胞周期を参照してください)
免疫監視機構からの逃避
生体は異物の侵入に対してこれを排除する免疫機構を備え、癌細胞に対してもこの機構が働きます。
しかし、癌細胞はもともと宿主由来であるため、その抗原性は宿主と類似しており、宿主側からみて、癌細胞を異物として認識し難いのです。
さらに、これに癌細胞の抗原性が容易に変化すること、また、多くの癌患者では免疫機能が低下していることなどの要因も加わり、 癌細胞は宿主の免疫監視機構から逃れて増殖を続けるのであります。
前述の「腫瘍免疫」を参照ください。
がん(癌)幹細胞とは
発がん(癌)の原因はなにか?

