タ行
胎児化
胎児期に発現する細胞とがん細胞はいくつか類似している点がある。
そのうちの一つとして、
胎児期にしか発現しないはずのたんぱく質が、がん細胞で見つけることができるのである。
このように、
腫瘍で発見される胎児性タンパクをがん胎児性タンパク質と言い、この現象を胎児化と言う。
がん胎児性タンパク質はそれぞれの腫瘍によって特異的である。
つまり、腫瘍の種類が異なればがん胎児性タンパク質に違いの出るのである
例えば、肺がんと大腸がんでは、発現するがん胎児性タンパク質が異なっている。
このがん胎児性タンパク質を見分けることができれば、どの腫瘍が発現しているかを判断することができる。
つまり、がんの診断に利用できるのである。
このように、
がん胎児性タンパク質は腫瘍マーカーとして利用される。
AFP(α-フェトプロテイン)肝細胞癌 卵黄嚢腫瘍 など
AFP-L3%(AFPレクチン分画)肝細胞癌
BFP(塩基性フェトプロテイン)各種癌
尿中BFP 膀胱癌
CEA(癌胎児性抗原) 大腸癌 胃癌 膵癌 胆道癌 肺癌 子宮癌 卵巣癌 乳癌 等
乳汁中CEA 乳癌
代謝物
その生物の生命活動に必須な物質を一次代謝産物と呼びます。
一方、一次代謝産物からつくり出され、その生物の生命活動に必須でない独特な物質もあり、これを二次代謝産物と呼びます。
抗生物質や色素といったものがその代表例です。
人類は昔から、これらの二次代謝産物を薬・香料・染料などの生物資源として利用してきました。
多血症
血液に含まれる赤血球量が絶対的、あるいは相対的に増加する血液の状態であり、単に多血症という一つの疾患があるものではなく赤血球量が増えるさまざまな疾患・状態を含む概念である。
多血症には大きく分けて、赤血球量は増えていないが血液の液体成分である血漿が減少するために血液単位体積あたりの赤血球量が増える相対的多血症と、全身での赤血球量が増える絶対的多血症があり、さらに絶対的多血症はなんらかの原因でエリスロポエチンの産出が増える為に起こる二次的多血症と、真性多血症などの造血細胞の腫瘍性増加に分けられる。
多臓器不全(MOF multiple organ failure)
生命維持に必要な複数の臓器の機能が障害された状態のこと。
現代救急医療の最大の課題のひとつとされている。
局所障害が枢要臓器に影響することによるPrimary MOFと、全身性炎症反応症候群から発展して生じるSecondary MOFがある。
MOFの基本的な病態は、急性炎症反応とこれにともなう各種サイトカインなど化学伝達物質の発現増大によって、全身において同時多発的に障害を生じることにある。
主な障害は下記のとおりである。
血管拡張と血流分布異常:NF-κBの活性化によってもたらされるもので、血液分布異常性ショックを誘発する。
ただし後述の血管内皮障害が進展すると血管は収縮に転じる。
心収縮性の障害:アドレナリンβ受容体とアデニル酸シクラーゼの間の情報伝達を阻害してカテコラミン反応性が低下することで生じるもので、心原性ショックを誘発する。
血管透過性亢進:好中球浸潤に伴うエラスターゼ放出による細胞障害などによって生じるもので、急性呼吸窮迫症候群や循環血液量減少性ショック(英語版)などを誘発する。
血管内皮障害:NF-κBやケモカイン受容体の活性化によってもたらされるもので、微小血栓形成による塞栓や血流鬱滞を誘発する。
糸球体濾過量減少:血流分布異常や血管内皮障害による虚血、また炎症性サイトカインによって生じるもので、急性腎不全に発展する恐れが大である。
「多臓器」の定義はやや曖昧であるが、日本では多くの場合、
肺・肝臓・腎臓・消化器系・循環器系・中枢神経系・凝固・線溶系の7つの機能のうち2つ以上が短期間ないし同時に不全になったときとされる。
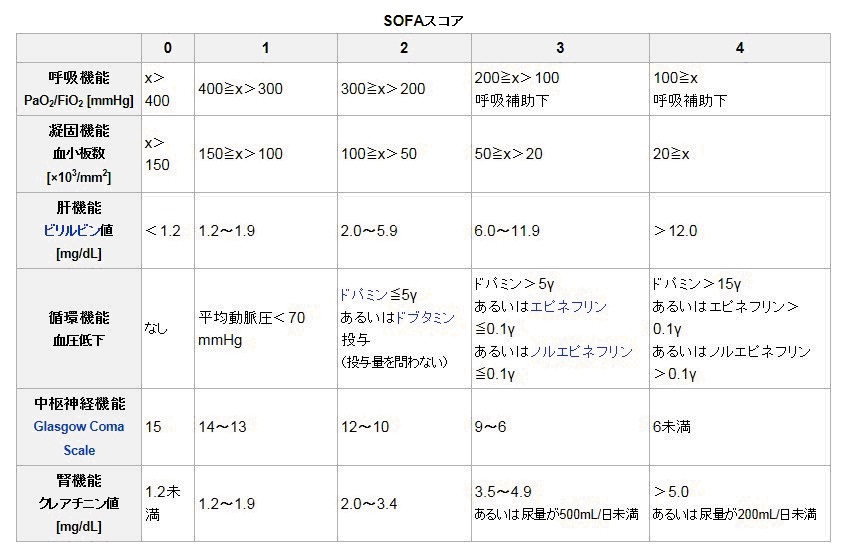
重症度の判定には、SOFAスコアやAPACHE-IIスコアなど、いくつかの指標が提案されている。SOFAスコア(Sequential Organ Failure Assessment score)は簡便であるために比較的多用されており、2009年新型インフルエンザの世界的流行に際してマックマスター大学を中心として策定されたトリアージプロトコルでも採用された。
現在のところ、各臓器の機能不全を個々に治療することはできるものの、これらが関連して一時に発生した場合、それぞれに対処していく以外に治療法がないのが現状である。
このことから、MOFの状態に陥る以前にこれを予防することが最重要であり、その前段階である全身性炎症反応症候群(SIRS)の時点で対策を講じることが必要である。
多糖類
糖質
1.糖質には単糖類、少糖類、
多糖類がある。
単糖類:グルコース(ブドウ糖)、ガラクトース、マンノース、フルクトース
少糖類(オリゴ糖類):単糖類が少数結合したもの。2個結合したものは二糖類。
二糖類:ラクトース(乳糖)=ガラクトース+グルコース
スクロース(ショ糖)=グルコース+フルクトース
マルトース(麦芽糖)=グルコース+グルコース
多糖類:単糖類が多数結合したもの。
グルコースが多数結合してできた多糖類:グリコーゲン(動物の肝臓と筋肉に多い)
デンプン(植物)
2.単糖類
特徴:アルデヒドまたはケトンの性質を示す。水酸基を複数持つ。
分類:アルドースとケトース
炭素数による分類
三炭糖(トリオース)、四炭糖、五炭糖(ペントース)、六炭糖(ヘキソース)
例)リボース:五炭糖(ペントース)でアルドース
グルコース、ガラクトース、マンノース:六炭糖(ヘキソース)でアルドース
フルクトース:六炭糖(ヘキソース)でケトース
単糖類と異性体
異性体:同じ分子式であるが構造の異なるもの。
DとL:天然の単糖類は大部分がD型。
光学異性体=鏡像異性体 D型とL型は鏡像異性体。
不斉炭素原子:4つの腕に結合するものがすべて異なるもの
グルコース、ガラクトース、マンノースは互いにエピマーという異性体である。
単糖類は、鎖状構造と環状構造を取り得る。
環状構造にはα型とβ型がある:アノマーという異性体。
ヘミアセタール(またはヘミケタール)のOH基が環状構造では生ずる。
→この向きがα型、β型を決定。
単糖類の誘導体にウロン酸、アミノ糖、デオキシ糖などがある。
グルクロン酸:グルコースからできるウロン酸
グルコサミン:グルコースからできるアミノ糖
ガラクトサミン:ガラクトースからできるアミノ糖
デオキシリボース:リボースからできるデオキシ糖
3.少糖類
少数この単糖がグリコシド結合でつながって出来る。
グリコシド結合
ヘミアセタール(またはヘミケタール)のOH基と他のOH基の間にできる結合。
例)α1-4結合ではαはアノマーの種類を、1,4は炭素原子の番号を示す。
4.多糖類
ホモ多糖とヘテロ多糖
グルコースからなるホモ多糖
アミロース
:α1-4結合、デンプンの成分、植物性。
アミロペクチン
:α1-4結合(α1-6結合の分枝)デンプンの成分、植物性。
グリコーゲン
:α1-4結合(α1-6結合の分枝)、動物性。
セルロース
:β1-4結合、植物性、人は消化できない。
グリコサミノグリカン(ムコ多糖)
:ヘテロ多糖、結合組織の主要な細胞外成分
アミノ糖とウロン酸(ガラクトース)が交互に結合している。
例)ヒアルロン酸、コンドロイチン硫酸、ヘパリンなど。
5.プロテオグリカン
タンパク質が結合したグリコサミノグリカン。
6.糖タンパク質
少糖類(オリゴ糖類)が結合したタンパク質。
短鎖脂肪酸
脂肪酸とは、油脂を構成する成分のひとつで、数個から数十個の炭素が鎖のように繋がった構造をしています。
そのうち炭素の数が6個以下のものが
短鎖脂肪酸と呼ばれ、それには酢酸、プロピオン酸、酪酸などが含まれます。
短鎖脂肪酸は、ヒトの大腸において、消化されにくい食物繊維やオリゴ糖を腸内細菌が発酵することにより生成されます。
生成された短鎖脂肪酸の大部分は大腸粘膜組織から吸収され、上皮細胞の増殖や粘液の分泌、水やミネラルの吸収のためのエネルギー源として利用されます。
また、一部は血流に乗って全身に運ばれ、肝臓や筋肉、腎臓などの組織でエネルギー源や脂肪を合成する材料として利用されます。
その他にも短鎖脂肪酸には、腸内を弱酸性の環境にすることで有害な菌の増殖を抑制する、大腸の粘膜を刺激して蠕動運動を促進する、ヒトの免疫反応を制御する、などさまざまな機能があることが知られています。
単純脂質
アルコールと脂肪酸のみがエステル結合してできている脂質を単純脂質という。
生物では、エネルギーの貯蔵や組織の保護などに利用される。
生物中に多く見られる単純脂質は、アルコールとしてグリセリンをもつもので、これらを総称してアシルグリセロール(英: Acylglycerol)またはグリセリド(グリセライド、英: Glyceride)と呼ぶ。
生物的観点からは中性脂肪と呼ばれることも多い。
グリセリンには3つのヒドロキシル基があり、エステル結合した脂肪酸の数によってモノグリセライド(Monoglyceride)・ダイグリセライド・トライグリセライドと分けられる。生体中では主に脂肪として蓄えられ、必要に応じてエネルギー源として使用される。
エーテル型脂質のアルキルエーテルアシルグリセロール(アルキルエーテルグリセライド)もここに分類される。
アルコールとして長鎖アルコールを持つものは蝋(ろう)と呼ぶ。動物や植物表面に多く見られ、保護物質として働いている。
一部の植物を除いて、エネルギー源とはならない。
グリセリンの代わりに、スフィンゴシンとアルコールがアミド結合したセラミドも単純脂質に分類される。
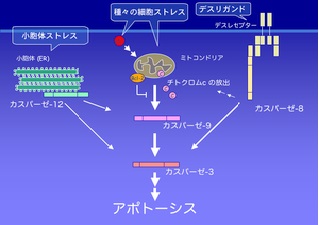
チトクロムc
チトクロムcはミトコンドリアで電子伝達系の構成要素を成す。
細胞がアポトーシス誘導刺激を受けると、ミトコンドリアからチトクロムcが放出される。
これは、細胞内のカルシウムイオン濃度が上昇することで、ミトコンドリアPTP(permeability transition pore)の開口が促されることによる。少量放出されたチトクロムcは小胞体膜上にあるIP3受容体と相互作用し、小胞体からカルシウムが放出される。
このプロセスにより、濃度が上がったカルシウムはチトクロムcの大量放出を引き起こし、正のフィードバックループを形成して小胞体からのカルシウム放出を持続させる。
これにより、
小胞体から放出されたカルシウムの量は細胞毒性をきたすまで上昇する。
細胞質中に放出されたチトクロムcは、今度はカスパーゼ9と呼ばれるシステインプロテアーゼを活性化する。
カスパーゼ9はカスパーゼ3とカスパーゼ7を活性化し(カスパーゼカスケード)、
最終的にアポトーシスを引き起こす。
腸内微生物群
ヒトをはじめ哺乳動物は、母親の胎内にいる間は、基本的に他の微生物が存在しない無菌の状態にある。
生後3-4時間後には、外の環境と接触することによって、あるものは食餌(しょくじ)を介して、あるものは母親などの近親者との接触で、あるものは出産時に産道で感染することによって、さまざまな経路で微生物が感染し、その微生物の一部は体表面、口腔内、消化管内、鼻腔内、泌尿生殖器などに定着して、その部位における常在性の微生物になる。
一部の原生動物や古細菌を除き、その多くは真正細菌である。
一般には常在細菌と総称されることが多い。
このうち消化管の下部にあたる、腸管内の常在細菌が腸内細菌である。
ヒトの腸内には一人当たり1000種類以上の腸内細菌が存在しており、一人当たり160種以上、100兆個以上の腸内細菌が生息、糞便のうち、約半分が腸内細菌またはその死骸であると言われている。
宿主であるヒトや動物が摂取した栄養分の一部を利用して生活し、他の種類の腸内細菌との間で数のバランスを保ちながら、一種の生態系(腸内細菌(さいきん)叢(そう)、腸内常在微生物叢、腸内フローラ)を形成している。
腸内細菌の種類と数は、個体差、消化管の部位、年齢、食事の内容や体調によって違いが見られるが、その大部分は
偏性嫌気性菌であり腸球菌など培養可能な種類は全体の一部であり、VNC(培養不能菌)の種類も多数存在する。
なお、その名称から腸内細菌の代表のように考えられている大腸菌は、全体の0.1%にも満たない。
腸内環境は嫌気性であり、腸内細菌の99%以上が
嫌気性生物である偏性嫌気性菌に属している。
これらの腸内細菌の代謝反応は
還元反応が
主体であり、また種々の分解反応が特徴的となっている。
嫌気呼吸の種類には、嫌気的解糖、硝酸塩呼吸、硫酸塩呼吸、炭酸塩呼吸などがあり、基質を還元することによって代謝に必要な電子を得ており、例えば、硝酸塩から亜硝酸塩を、硫酸塩から硫化水素を、炭酸からメタンを生成するような例がある。
腸内細菌叢を構成している腸内細菌は、互いに共生しているだけでなく、宿主であるヒトとも共生関係にある。
宿主が摂取した食餌に含まれる栄養分を主な栄養源として発酵することで増殖し、同時にさまざまな
代謝物を産生する。
腸内細菌が発酵によって作り出したガスや悪臭成分がおならの一部になる。
腸内細菌は、ヒトのような雑食動物において食物繊維を構成する難分解性多糖類を短鎖脂肪酸に転換して宿主にエネルギー源を供給したり、外部から侵入した病原細菌が腸内で増殖するのを防止する感染防御の役割を果たすなど、宿主の恒常性維持に役立っている。
しかし、腸管以外の場所に感染した場合や、抗生物質の使用によって腸内細菌叢のバランスが崩れた場合には病気の原因にもなる。
微生物二次代謝産物
二次代謝産物とは、多様な化学物質群に属する小さな化合物であって、種ごとに特有のものと見なされている。
モジュラーポリケチド合成酵素(PKS)および
非リボソームペプチド合成酵素(NRPS)は、細菌の二次代謝において組み立てラインのように段階的生合成を行なう多酵素系である。
多くのポリケチドやリボソームを介さずにつくられたペプチドは、
抗生作用や抗真菌性、細胞傷害性といった興味深い生理活性を有する。
こうした性質以外にも、一部のポリケチドやペプチドは産生主体の生物の生理に重要な役割を果たしていることが報告されている。
生化学的、遺伝学的および進化学的研究によって、PKSやNRPSがもたらす膨大な構造的多様性の機序が解明されている。
生物は、様々な構造を作り出すために、二次代謝をまるで実験室あるいは「化学の遊び場」のように利用しているものと思われる。
こうした構造のほとんどは時間が経つと失われてしまうが、特異的機能を発揮するために新たに獲得された時はその構造は保存される。
この構造固定過程については、
ほとんど知見が得られていないのが現状である。
この過程には、適当な調節パターンの発達および既存の調節ネットワークへのパターンの統合化という2つの事象が必要であるため、システム生物学に関連したアプローチを取ることが、新たな洞察を得るための最良の手段である。
システム生物学は、生命体を様々なレベルで総合的に理解しようとする学問である。
一方、進化システム生物学は、生物システムの経時的変化の道筋に焦点を当てるものである。
再構築された代謝ネットワーク、遺伝子発現データ、系統発生ゲノミクス、および比較ゲノミクスを総合的に活用することで、二次代謝の進化動態の理解が深まるであろう。
直線しきい値無し仮説
放射線の被ばく線量と影響の間には、しきい値がなく直線的な関係が成り立つという考え方を「しきい値無し直線仮説」と呼びます。
■確定的影響と確率的影響
放射線の人体への影響は、「確定的影響」と「確率的影響」の2つに分けけることができます。
このうち、確定的影響には主に高線量被ばく時に見られる障害で、脱毛を含む皮膚の障害や、骨髄障害あるいは白内障などが含まれ、それ以下では障害が起こらない線量、すなわちしきい値のあることが知られています。
一方、発がんを中心とする確率的影響ついては、1個の細胞に生じたDNAの傷が原因となってがんが起こりうるという非常に単純化された考えに基づいて、影響の発生確率は被ばく線量に比例するとされています。しかし、実際には、広島・長崎の原爆被爆者を対象とした膨大なデータをもってしても、100ミリシーベルト程度よりも低い線量では発がんリスクの有意な上昇は認められていません。これよりも低い線量域では、発がんリスクを疫学的に示すことができないということです。
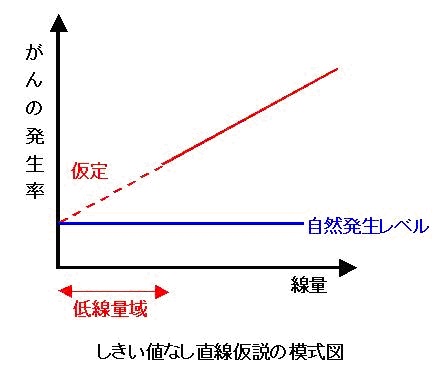
■なぜ「仮説」なのか?
このように確たる情報に乏しい低線量の範囲について、放射線防護の立場からリスクを推定するために導入されたのがLNT仮説です。低線量放射線の影響についてはよくわからないが、影響があると考えておいた方が安全側だという考え方に基づいたもので、科学的に解明されたものではないことから「仮説」と呼ばれています。
■LNT仮説の問題点
各種の線量限度等を勧告している国際放射線防護委員会(ICRP)でも、「この仮説は放射線管理の目的のためにのみ用いるべきであり、すでに起こったわずかな線量の被曝についてのリスクを評価するために用いるのは適切ではない」としています。
それにもかかわらず、微量の被ばくに対してLNT仮説を用いてリスクが評価される場合が後を絶たず(*1)、このような情報を受け取った一般の方々に誤解を与え、放射線に対する恐怖感、不安感を助長する結果になっています。
■低線量放射線研究からわかってきたこと
これまでの当センターを含めた多くの低線量放射線研究から、LNT仮説では説明できない事例が数多く見つかっています(*2)。また、当センターを含めた国内外の研究成果をとりまとめた「線量・線量率マップ」(*3)からは、放射線は一度に被ばくした場合と、少量ずつ時間をかけて被ばくした場合とでは影響が異なることも明らかになっています。このことは、放射線作業従事者が少量の放射線を何度も被ばくするような場合には、LNT仮説から予想されるよりも実際のリスクはずっと小さくなることを示唆しています。
資料提供 原子力技術研究所 放射線安全研究センター
テネイシン
細胞外マトリックスの巨大な糖タンパク質で、脊椎動物の発生過程の胚に多く存在し、形態形成に関与している。
組織修復、癌に関係している。
デフェンシン
脊椎動物および無脊椎動物双方に見出される正電荷を持ったタンパク質(オリゴペプチド)である。
ディフェンシンは、真正細菌(バクテリア)・真菌類・ウイルス・ウイロイドに対して活性を持つ
抗微生物ペプチドである。
18から45アミノ酸からなり、6個(脊椎動物)から8個の保存された
システイン残基を含む。
好中球などの免疫系の細胞やほとんどの上皮細胞は、細胞に取り込んだバクテリアなどの異物を不活性化するためにディフェンシンを内部に持っている。
大部分のディフェンシンは、微生物の細胞膜と結合することによって機能し、いったん結合が起きると重要なイオンと栄養分が流出する孔のような膜の欠損を作る。
機能
幼い有袋類の個体は、誕生のときには免疫系の発達が不十分であるので、ディフェンシンは病原体への防御で重要な役割を果たす。
該当する若い個体で作られるだけでなく、母乳の中にも分泌されている。
ヒトゲノムはθ-ディフェンシン遺伝子を含んでいるが、それらには終止コドンが途中に含まれており、発現が阻害されている。
人工的なヒトθ-ディフェンシンであるレトロサイクリンは、偽遺伝子を「修復する」ことで作られ、ヒト免疫不全ウイルスおよび単純ヘルペスウイルス・A型インフルエンザウイルスを含む他のウイルスに対して効果的であることが示された。
レトロサイクリンは、これらウイルスが標的細胞に侵入するのを防止することで機能している。
転写因子
DNAに特異的に結合するタンパク質の一群である。DNA上のプロモーターやエンハンサーといった転写を制御する領域に結合し、DNAの遺伝情報をRNAに転写する過程を促進、あるいは逆に抑制する。
転写因子はこの機能を単独で、または他の蛋白質と複合体を形成することによって実行する。
ヒトのゲノム上には、転写因子をコードする遺伝子がおよそ1,800前後存在するとの推定がなされている。
転写・RNAポリメラーゼによってDNA をmRNAにコピーすること。
因子・特定の生化学反応や身体過程に係わる物質。例えばタンパク質など。
転写制御・RNAポリメラーゼのDNAへの結合を促進あるいは阻害して、遺伝子転写のレートを調節すること。
活性化または促進・遺伝子転写レートを上昇させること。
抑制・遺伝子転写レートを下降させること。
同化反応
エネルギーを使って有機物を合成する。
頭頚部がん
頭頸部領域に発生した悪性腫瘍です。耳鼻咽喉 科頭頸部外科領域の悪性腫瘍の特徴として、
1)聴覚、平衡覚、嗅覚、味覚などの感覚器を含む
2)呼吸、発声、摂食、嚥下などに密接に関係している
3)組織に余裕がない
4)衣服で覆われない部分が多い
5)比較的放射線感受性が高い腫瘍が多い、などがあげられます。
1から4のような特徴があるため悪性腫瘍治療で最も大切な根治性とQOL(生活の質)の保 持をバランスよく保つことが難しいのです。
頭頸部癌としては、主に以下の部位があげられます。
耳
- :聴器癌
鼻・副鼻腔
- :鼻腔癌、上顎癌
口腔
- :舌癌、口腔底癌など
咽頭
- :上咽頭癌、中咽頭癌、下咽頭癌
喉頭
- :喉頭癌
頸部
- :甲状腺癌、原発不明癌など
唾液腺
- :耳下腺癌、顎下腺癌など
耳鼻咽喉科(頭頸部外科)が、これらの癌を対象としています。
頭頸部癌が全癌に占める割合は約5%にすぎず、この中に多くの部位が存在しますので、各 部位別に分けるとその頻度としては少なくなります。
しかし、好発年齢を考えると、将来の高齢 化社会とともに増加する可能性があります。
頭頸部癌は、発生部位により癌の性質が異なる ため、治療法も異なります。
また、同じ部位の癌でも病期によって治療法が異なります。
従って、原発巣の部位の確定と病期の把握が重要となります。
病期は原発巣の進行度、頸部リンパ節転移、遠隔転移の3項目で決定されます。
それぞれについて正確な診断をし、正確な病期を決定する必要があります
糖鎖
糖鎖(とうさ)とは、各種の糖がグリコシド結合によってつながりあった一群の化合物を指す。
結合した糖の数は2つから数万まで様々であり、10個程度までのものをオリゴ糖とも呼ぶ。多数のα-グルコース分子が直線上に結合したアミロースやセルロースは最も単純な糖鎖といえる。
一般的に、糖鎖はN-アセチルガラクトサミン、N-アセチルグルコサミン、ガラクトース、フコース、シアル酸などから構成されているが、糖鎖は糖同士だけでなく、タンパク質や脂質その他の低分子とも結合して多様な分子を作り出している。
これら糖タンパク質、糖脂質は生体内で重要な生理作用を担う。
生体内では、アミロースやアミロペクチン、グリコーゲンなどは、グルコースを多数結合させて、体内でのエネルギー源として保存しやすい形に蓄積したものといえる。
またセルロースやキチンなどは丈夫な繊維になるため、動植物の体を構築する素材として重要である。
糖タンパク質の糖鎖には、セリンやスレオニンのヒドロキシ基にα結合しているO-グリコシド結合糖鎖と、アスパラギンのアミノ基にβ結合しているN-グリコシド結合糖鎖がある。N-グリコシド結合糖鎖はサイトソルと小胞体で合成され、オリゴ糖転移酵素 (OST) によってタンパク質のアスパラギンに結合させられる。
この糖鎖は
熱ショックタンパク質のフォールディング に関わっているものもあり、それらはシャペロンといわれる。
O-グリコシド結合糖鎖には
ムチン型糖鎖、
プロテオグリカン、
糖脂質などがある。
細胞表面にもシアル酸を含むガングリオシドなどの糖鎖は存在しており、これらは細胞接着、抗原抗体反応、ウィルスの感染など細胞のコミュニケーションに重要な役割を担う。例えば
血液型(ABO式)の違いを作り出しているのも、糖鎖の構造の差である。
また生理活性を持つ低分子の中にも糖鎖を持つものがあり、これらはDNAの特定の配置を認識して結合するなどしてその作用をアシストしている。
糖鎖はタンパク質・DNAに続く第3の
バイオポリマーと呼ばれ、その重要な特性は構造の多様性にある。
タンパク質・DNAの素材であるアミノ酸や核酸塩基は一列に並ぶことしかできないのに対し糖は多数のヒドロキシ基が全て結合に活用しうるため、枝分かれして複雑な構造を作り出すことができる。
またグリコシド結合のα・βの異性体も考え合わせれば、考えられる糖鎖の数はさらに増える。
糖の種類自体もペントース、ヘキソース、アミノ糖、ウロン酸類、デオキシ糖などバリエーションが多いため、糖鎖の種類は実に膨大なものになる。
糖鎖が情報を担う分子であるのは、こうした条件によっているといえる。
ムチン:上皮細胞などから分泌される粘液の主成分として考えられてきた粘性物質である。糖を多量に含む糖タンパク質(粘液糖タンパク質)の混合物であり、細胞の保護や潤滑物質としての役割を担っている。
糖鎖はムチンの分子量の50%以上を占め、ムチンのもつ強い粘性や水分子の保持能力、タンパク質分解酵素への耐性など、さまざまな性質の要因となっている。
ムチンには、上皮細胞などが産生する分泌型ムチンと、疎水性の膜貫通部位を持ち細胞膜に結合した状態で存在する膜結合型ムチンがある。
一般的に強い粘性(ぬめり)を持ち、保水性も非常に高く、生体の分泌する粘液にはほぼ全てムチンが含まれており、口腔、胃、腸をはじめとする消化器官や鼻腔、腟、関節液、目の表面の粘膜は、すべてムチンに覆われているといえる。
プロテオグリカン:細胞外マトリックスや細胞表面、軟骨などに多く存在し、組織形成や伝達物質など身体組織の形成と維持のための重要な成分であると考えられている。
生体成分として多様な機能性を持つと考えられるプロテオグリカンは、もっとも重要な生体成分であり、主要な各種臓器、脳、皮膚を始めとした体全体の組織中の細胞外マトリックスや細胞表面に存在するほか、関節軟骨の主成分としても存在している。
プロテオグリカンは、組織形成や伝達物質としての役割など、組織維持修復に関係する成分である。
また、プロテオグリカンは、コラーゲンやヒアルロン酸とマトリックスを作ることで身体組織や皮膚組織を維持している。
糖脂質:糖を結合した脂質である。
糖脂質は細胞膜の表面でリン脂質と結合した状態で存在し、全ての真核生物の細胞膜表面で見られる。
脂質二重膜内部から膜表面へ突き出すように存在し、特定の化合物の認識サイトとして働いている。
この働きによって細胞膜が安定し、別の細胞と結合して組織を形成するのに役立っている。なお、糖脂質は、細胞膜の二重層のうち外側にしか存在しない。
これは、細胞膜の形成時に糖を付加する酵素がゴルジ体の内部にしか存在しないこと、糖脂質を外層から内層に輸送するフリッパーゼが存在しないことによる。
糖脂質の種類:ガラクト脂質、スルホ脂質 、 スフィンゴ糖脂質、セレブロシド、
ガラクトセレブロシド、 グルコセレブロシド、ガングリオシド 、 糖スフィンゴリン脂質、
糖鎖は「細胞の顔」とも言われ、細胞間のコミュニケーションをとるためのアンテナの役割をしていると考えられています。
たとえば、私たちが人の顔をみて相手が誰かを見分けるように、からだのなかの細胞同士は表面の糖鎖によって認識し合い、そして糖鎖を介して必要な情報のやりとりをしています。
近年、いのちの誕生から老化まで、生命現象の様々な場面における糖鎖の重要な役割が明らかにされつつあります。
ヒトゲノムの解読が完了した後、「ポストゲノム」として生命科学分野で注目されているのが、糖質科学なのです。
糖タンパク質
タンパク質を構成するアミノ酸の一部に糖鎖が結合したものである。
動物においては、細胞表面や細胞外に分泌されているタンパク質のほとんどが糖タンパク質であるといわれている。
タンパク質のアミノ酸の修飾では、
アスパラギンに結合したもの(N結合型)とセリンやスレオニンに結合したもの(O結合型、ムチン型)の2種類が頻繁に観察される。
糖タンパク質に結合している
糖鎖を成す糖の種類はそれほど多くなく、よく見られるものはグルコース、ガラクトース、マンノース、フコース、N-アセチルグルコサミン、N-アセチルガラクトサミン、N-アセチルノイラミン酸、キシロースなど7~8種程度である。構造様式もある程度限られており、その中のわずかな構造の違いが識別され、精密に認識されて様々な生命現象が制御されている。
トランスクリプトーム
特定の状況下において細胞中に存在する全てのmRNA(ないしは一次転写産物、 transcripts)の総体を指す呼称である。
ゲノムは原則として同一個体内のすべての細胞で同一だが、トランスクリプトームでは状況が異なり、同一の個体にあっても組織ごとに、あるいは細胞外からの影響に呼応して固有の構成をとる。
トランスクリプトミクス(transcriptomics)とはトランスクリプトームを扱う学問である。トランスクリプトームの様態は、例えば
DNAマイクロアレイの様に一度に幾万ものmRNAを識別する能力を持つ技術をもって解析される。
遺伝子産物であるmRNAの階層の要素が、蛋白質の階層の要素と一対一に対応するとは限らない。
蛋白質から構成されるシステムは、トランスクリプトームと同様な枠組みで理解され、プロテオームという概念で認識されている。
トランスクリプトームの研究は生命を司る物質流転(メタボローム)を探求する上で残された重要な分野である。
DNAマイクロアレイ:DNAチップとも呼ばれ、細胞内の遺伝子発現量を測定するために、多数のDNA断片をプラスチックやガラス等の基板上に高密度に配置した分析器具のこと。
あらかじめ塩基配列の明らかな1本鎖のDNAを多種、基板上に配置しておき、これに検体を反応させれば、検体のDNA配列と相補的な塩基配列の部分にのみ検体のDNA鎖が結合する。
結合位置を蛍光や電流によって検出し、最初の配置から検体に含まれるDNA配列を知る事が出来る。
検体の塩基配列が予測できる場合には、効率的にその配列が特定できる。
トランスフォーミング増殖因子
(Transforming growth factor、TGF)
自然に存在する多くの特色ある増殖因子の1つである。
他の多数のシグナル経路と同様に組織発生、細胞分化、胚発育における極めて重要な役割を果たす。
アルファ型トランスフォーミング増殖因子TGF-αはいくつかのヒトのガンで過剰発現している。
またこれは、マクロファージ、脳細胞、ケラチノサイトで産生され、上皮の発生を引き起こす。
ベータ型変異増殖因子TGF-βは腎臓、骨髄、血小板などほぼすべての細胞で産生され、5種類のサブタイプ(β1~β5)が存在する。
骨基質中にはそのうちβ1~β3がいずれも不活性型として蓄積され、骨吸収の際に破骨細胞が放出する酸によって活性化される。
骨芽細胞の増殖およびコラーゲンのような間葉細胞の合成・増殖を促進し、上皮細胞の増殖や破骨細胞に対しては抑制的に作用する。
また、TGF-βスーパーファミリーというものもあり、これには生物の骨形成に重要な役割を果たしているBMP(骨形成タンパク質)などが含まれる。
TGF受容体(TGFR)はマイトーゲン活性化タンパク(MAP)キナーゼファミリーの一部である。ホモまたはヘテロダイマーになる多くの異なるアイソフォームが存在している。
TGFスーパーファミリーに同定されたリガンド数はその受容体の数より遥かに少なく、リガンドと受容体の相互作用の間は乱雑である。
TGFRは7回膜貫通型受容体である。
脳、心臓、腎臓、肝臓、および睾丸を含む多くの異なったタイプの組織でそれを見られる。TGFの過剰発現は、腎硬変(腎臓の繊維症)を引き起こし、糖尿病と同様に腎臓病の原因となり、最終的に末期腎臓病 (ESRD) となる。
TGFベータ受容体に対し、あるタイプのタンパク質阻害剤を使用することで、腎臓の繊維症の効果を止め、逆にすることもできる。
トロンボスポンジン
血小板が分泌するタンパク質で、ヘパリン、フィブリノーゲン、カルシウムイオンと結合して血液凝固に関与するほか、細胞外マトリックス分子とも相互作用する。
トロンボモデュリン(TM)
内皮細胞の細胞上でトロンビンを凝固酵素から抗凝固酵素へと変換する膜タンパクである。すなわちTM分子の4、5、6番目のEGF様ドメインにトロンビンが結合すると血小板活性化能や凝固因子活性化能が消失し、逆にプロテインC活性化能が著しく増強される。
活性化プロテインCは、活性化第V、第VIII因子を分解し、凝固反応をストップさせる。このTMの抗血栓作用は、TM分子の4、5、6番目のEGF様ドメインに活性がある。
一方、HMGB1は本来、DNA結合タンパクであるが、細胞外に出てくると、RAGEやToll-like receptor-2,-4を介して種々の細胞を活性化する。このHMGB1は局所では免疫と止血の誘導、未分化間葉系細胞を誘導し、損傷部位の止血、感染防御、組織の修復に重要な役割を果たす。
しかしこの
HMGB1が全身を循環すると、炎症転移のメディエーターとして作用し、ショックや多臓器不全を引き起こす。
我々は先に、
TMのN末端領域にHMGB1が結合し、HMGB1の作用を消去することを見出した。さらに以前に我々はTMには、ラディカルスカベンジャー作用があることも報告している。
そこで、本研究では、トロンビン、HMGB1、ラディカルが血中に増加して多彩な病態を発現するエンドトキシンショックにTMがどのような働きをするのか検討し、以下の結論を得た。
1.TMは感染や外傷部位で発生するトロンビンのみでなく、HMGB1、ラディカルをも消去して、生体の循環内を守護している。
2.血管内TMをダウンレギュレーションすると、これらのメディエーターに対する閾値が低下し、DICをはじめとする病態が惹起される。
TMの補充は、DICのみでなく、ショックやSIRSをも改善する。
▼ タ行先頭へ