PQRST
P53・P53遺伝子・P53癌抑制遺伝子
p53のpはタンパク質(protein)、53は分子量53,000を意味しタンパクは393個のアミノ酸から構成されている。
人間では、23対ある染色体の17番目にある。
この遺伝子は進化的に保存されており、昆虫や軟体動物にも存在している。
ただしそれらのアミノ酸一次配列はかなり多様化している。
また
相同としてp63やp73もある。
RB遺伝子とともによく知られている。
p53タンパク質は転写因子として働き、多くの遺伝子群の発現に関与し多彩な生理機能を持つ。
P53遺伝子の機能
・ 損傷を受けたDNAの修復タンパク質の活性化
・ 細胞周期の制御
・ DNAが修復不可能な損傷を受けた場合に、細胞の自殺であるアポトーシスを誘導
この遺伝子による機能が不全となるとがんが起こると考えられている。
いわゆる
癌抑制遺伝子の一つ。
半数以上の悪性腫瘍においてp53遺伝子の変異や欠失が認められる。
変異の多くは点変異である。
何らかの原因でp53遺伝子が損傷を受けると、細胞にアポトーシスが誘導されにくくなる。
例えば、肺癌ではタバコに含まれるベンゾピレンという発癌物質によりp53遺伝子の変異が起こっている。
また、肝細胞癌の原因の1つであるピーナッツに生えるカビが産生するアフラトキシンという物質は、p53遺伝子の249番目の塩基に点変異を多く引き起こす。
細胞が、がん化するためには複数の癌遺伝子と癌抑制遺伝子の変化が必要らしいことが分かっているが、p53遺伝子は悪性腫瘍(癌)において最も高頻度に異常が認められている。
p53は、細胞の恒常性の維持やアポトーシス誘導といった重要な役割を持つことからゲノムの守護者(The Guardian of the genome)とも表現されるが、染色体構造が変化する機構と、それらの細胞内での働き、そしてそれらが生物にとってどのように大切なのかについてはよくわかっていない。
p53遺伝子の変異は抗p53抗体の出現と相関がみられる。
日本では抗p53抗体測定は食道癌、大腸癌および乳癌が疑われる際に2007年11月より保険適応が認められた。
「遺伝子治療への応用」
p53遺伝子の多彩な機能を利用して、癌の治療に応用しようとする試みがなされている。
特によく研究がなされているのは、アデノウイルスなどのベクターを用いて癌細胞へp53遺伝子を導入する治療である。
p53遺伝子に変異がある場合には、通常ではアポトーシスが起こるようなDNA障害が生じても細胞死が起こりにくい。
このため、一般的にはp53遺伝子に変異を持つ癌では薬剤や放射線などの治療に抵抗性が存在する。
遺伝子治療による癌細胞へのアポトーシスの誘導や、化学療法や放射線治療の効果の増強が期待されている。
p53と癌についてもう少し詳しくお知りになりたい方は、
[p53とヒトのがん]で検索してみてください。
PAI-1(plasminogen activator inhibitor-1)
脂肪細胞から分泌されるアディポサイトカイン (生理活性物質) の 1 つで、血液を固まらせる作用があります。肥満時には分泌が増加し、脳血栓や心筋梗塞などのリスクを高めます。
PAP(前立腺性酸性ホスファターゼ、prostatic acid phosphatase)
PAPは酸性領域に至適pHを有する加水分解酵素で、体内で広く分布しているが前立腺で大量に合成されます。
血中PAPは
前立腺癌の腫瘍マーカーとして、PAやγ-Smと伴に用いられます。
PAMP(Pathogen-associated molecular pattern)
自然免疫系は、生体に侵入した病原体をいち早く感知し、発動する第一線の生体防御機構である。
「病原体を感知(認識)する」ことは、自然免疫系を活性化するための必須の要素で、主にマクロファージや樹状細胞などによって行われる。
これらの細胞は、
パターン認識受容体(Pattern-recognition receptor: PRR)を介して微生物の持つ共通した分子構造(Pathogen-associated molecular pattern: PAMP)を認識する。
PRRは、PAMPを認識すると、細胞内シグナル伝達系を活性化し、病原体排除に必要な生体防御機構を誘導する。
また、第二の生体防御機構である獲得免疫系の誘導に樹状細胞が重要な役割を果たしているが、PRRによるシグナル伝達によって樹状細胞の成熟も促進される。
Toll-like receptor(TLR)はPRRとして初めて同定された受容体で、多くのPAMPを認識することが明らかとなっている。
TLRは、外部領域、膜貫通領域、細胞質内領域を持つI型膜貫通たん白質である。
外部領域に存在するロイシンリッチリピート部分でPAMPを認識し、細胞質内領域のToll-IL-1 receptor(TIR)部分で下流のシグナル伝達系を活性化する。TLRは細胞表面、あるいは細胞内小胞上に発現している。
これまでにヒトでは10、マウスでは12のTLRが同定されている。それぞれのTLRはウイルスや細菌、真菌、寄生虫固有のPAMPを認識する。
TLRはPAMPを認識すると、TIR(前述)にMyD88やTRIFというアダプター分子をリクルートすることによりNF-kBやMAPキナーゼ、IRF-3経路などのシグナル伝達系を活性化し、炎症性サイトカインやI型インターフェロン、ケモカイン、抗菌ペプチドの産生を誘導する。
PD-1(免疫チェックポイントたんぱく質)
PD-1(programmed cell death?1)受容体は、活性化 T 細胞(T細胞だけでなく,B細胞,ナチュラルキラー細胞,ナチュラルキラーT細胞,骨髄系細胞にも発現)の表面に発現します。
一方 PD-1受容体に特異的に結合する物質である PD-L1および PD-L2は、通常抗原提示細胞(樹状細胞、マクロファージ)の表面上に発現します。
活性化T細胞に発現するPD-1と抗原提示細胞(樹状細胞やマクロファージ)の表面上に発現するPD-L1(別名; B7-H1) および PD-L2(別名;B7-DC) は、T 細胞応答を抑制もしくは停止させる共同抑制因子として働く免疫チェックポイントたんぱく質(免疫グロブリンスーパーファミリーに属する膜たんぱく質PD-1やPD-L1)です。
PD-L1又はPD-L2が PD-1 に結合すると T 細胞からのサイトカインの産生が低下し、T細胞の活動を抑制するシグナルが伝達されます。
腫瘍の局所ではキラーT細胞およびナチュラルキラー細胞がPD-1を高く発現していて、抗腫瘍免疫応答の減弱の原因とされています。
このPD-1シグナルを抗PD-1抗体あるいは抗PD-L1抗体を使用して阻害し抗腫瘍免疫応答の減弱を抑制することによりその増強効果が得られることが推察され、抗PD-1抗体あるいは抗PD-L1抗体を用いPD-1とPD-L1との相互作用を阻害することにより癌免疫応答を増強できることが報告されています。
また、抗PD-1抗体は担癌に存在するPD-1陽性CD8陽性T細胞を再活性化することが報告されています。
PDGF(platelet-derived growth factor)
PDGF(血小板由来増殖因子)は、血液が凝固する時に血小板が崩壊するが、このとき放出される。
PDGFは血小板だけでなく、マクロファージ、平滑筋細胞、内皮細胞、繊維芽細胞からも分泌され、組織が傷つくと放出されて、細胞遊走と細胞増殖によって組織を修復、創傷治癒に関わる。
PDGFは単独では遊走作用のみしか示さず、増殖作用を発現するためにはEGF、IGFの共存が必須である。
つまり、傷ができると血小板からPDGFが放出されて、繊維芽細胞やマクロファージを遊走させて、血漿中のEGFやIGFとともに細胞増殖を促します。
Pgp(P糖タンパク質)
分子量約18万のリン酸化タンパク質であり、細胞膜上に存在して細胞毒性を有する化合物(例 抗がん剤)などの細胞外排出を行う。
P-gpはABCトランスポーターのMDR/TAPサブファミリーに属する分子であり、腸や肺、腎臓の近位尿細管、血液脳関門の毛細血管内皮細胞等に発現している。
また、P-gpによる薬物の排出は薬剤耐性の形成に寄与している。
P-gpはABCB1(ATP-binding Cassette Sub-family B Member 1)、あるいはMDR1(Multiple drug resistance 1)とも呼ばれる。
PIVKA-Ⅱ(異常プロトロンビン、protein induced by vitamin K absence-2)
PIVKA-Ⅱはビタミン欠乏時に産生される異常プロトロンビンの一種で、血液凝固因子としての活性を持ちません。
血中PIVKA-Ⅱは肝臓癌に特異性の高い腫瘍マーカーであり、
肝臓癌の診断や治療経過の観察に有用です。
PSA(前立腺特異抗原、prostate specific antigen)
PSAはヒト前立腺組織から発見された糖たんぱくであり、前立腺にのみ局在します。
血中PSAは前立腺癌に特異的な腫瘍マーカーであるが、前立腺肥大症でも高値を示すため、PAP、γ-Smと組み合わせて用いられます。
PTM:Post-translational modification
分子生物学などにおいては、翻訳(Translation)とは、mRNAの情報に基づいて、タンパク質を合成する反応を指す。
Post-translational modification略称PTMは翻訳後のタンパク質の化学的な修飾である。
これは多くのタンパク質の生合成の後方のステップの1つである。
タンパク質(またはポリペプチド)はアミノ酸の鎖である。タンパク質の生合成では、20種のアミノ酸はタンパク質に組み入れられる。翻訳後、アミノ酸の翻訳後修飾は、酢酸、リン酸、様々な脂質、炭水化物のような他の生化学官能基と結合し、アミノ酸(例えばシトルリン)の化学的特性の変換、またはジスルフィド結合の形成のような構造変換などタンパク質の反応の幅を広げる。
また、酵素がタンパク質のN末端からアミノ酸を輸送するか、中央からペプチド結合を切断することもある。
例えば、ペプチドホルモンであるインスリンはジスルフィド結合が形成された後に2つに切断され、C-ペプチド(右図の桃色のポリペプチド鎖部分)は結合から切り離される。(最終的にジスルフィド結合で2つのポリペプチド鎖が結合したタンパク質が生じる。)
この他の修飾にリン酸化がある。
この修飾はタンパク質酵素の作用の活発化と非活発化の調節機構においてよく起こる。
官能基付加
アシル化
- アシル基の付加で、通常、タンパク質のN末端に起こる。
アセチル化
- アセチル基の付加で、リシンとアルギニン残基に起こる。エタノイル化ともいう。
ヒストンが良く知られる例である。アセチル化、またその逆反応の脱アセチル化
はリシンとアルギニンの持つ陽電荷を中和しDNAとの結合状態に影響を与え
る事で、クロマチン構造を変化させ、遺伝子発現の変化を引き起こす。
アルキル化
- メチル基の付加はメチル化と呼ばれ、リシンとアルギニン残基に起こる。
ジメチル化
- アミド化はC末端で起こる
ビオチニル化
- ビオチンを付加させてリシン残基を保護する
ホルミル化
- γカルボキシル化 ビタミンKに依存する。
グルタミル化
- たんぱく質のグルタミン酸残基の共有結合によるチューブリンと他のタンパク質
との結合。
グリコシル化
- アスパラギン、ヒドロキシリシン、セリン、トレオニンにグリコシル基が付加し、糖
タンパク質ができる。メイラード反応では糖の付加は酵素無しで行われる。
グリシル化
- チューブリンのC末端尾の40以上のグリシン残基の1つの共有結合ヘム
共有結合の付加
ヒドロキシル化
ヨウ素化
- 甲状腺ホルモン
イソプレニル化
- イソプレノイドの付加(ファルネソール、ゲラニルゲラニオールなど)
リポイル化
プレニル化
GPIアンカー形成
ミリストイル化
ファルネシル化
ゲラニルゲラニル化
ヌクレオチドまたは誘導体への共有結合の付加
ADPリボシル化
FAD結合
酸化還元反応
ポリエチレングリコール化
ホスファチジルイノシトール
ホスホパンテテイニル化
脂肪酸、ポリケチド、非リボソームペプリド、ロイシンでの補酵素Aからの4'-ホスホパンテテイニルの付加。
リン酸化
- リン酸の付加。通常、セリン、チロシン、トレオニン、ヒスチジンで起こる。
ピログルタミン酸形成
ラセミ化
- プロリルイソメラーゼによるプロリンのラセミ化
tRNA
- アミノ酸付加による調停
チロシン硫酸化
- チロシンへの硫黄の付加
セレノイル化
- セレノタンパク質へのセレンの付加
タンパク質またはペプチドの付加
ISG化
- ISG15タンパク質への共有結合連鎖(インターフェロン刺激遺伝子)
SUMO化
- SUMOタンパク質への共有結合連鎖
(SUMO ; Small Ubiquitin-related MOdifier)
ユビキチン化
- ユビキチンへの共有結合連鎖
アミノ酸の化学的性質の変換
シトルリン化または脱アミン アルギニンをシトルリンに変換
脱アミド
- グルタミンをグルタミン酸、アスパラギンをアスパラギン酸に変換
構造の変換
ジスルフィド
- 2つのシステインの共有結合
プロテアーゼ
- タンパク質のペプチド結合の加水分解
修飾の例
加水分解とジスルフィド形成によるインスリンの形成
ヒストンの転写調節(クロマチン形成時のRNAポリメラーゼの調節)
RNAポリメラーゼIIの転写
QOLの評価質問表(患者さん用)
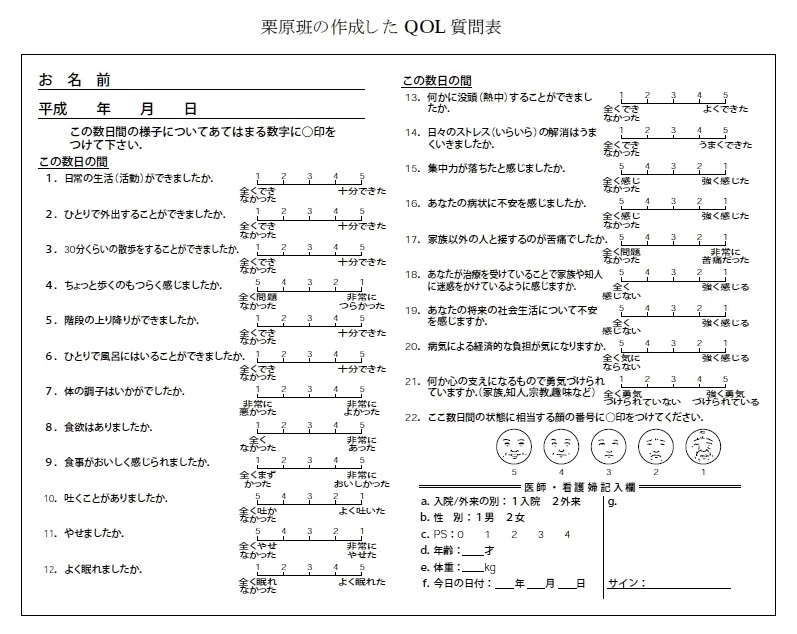
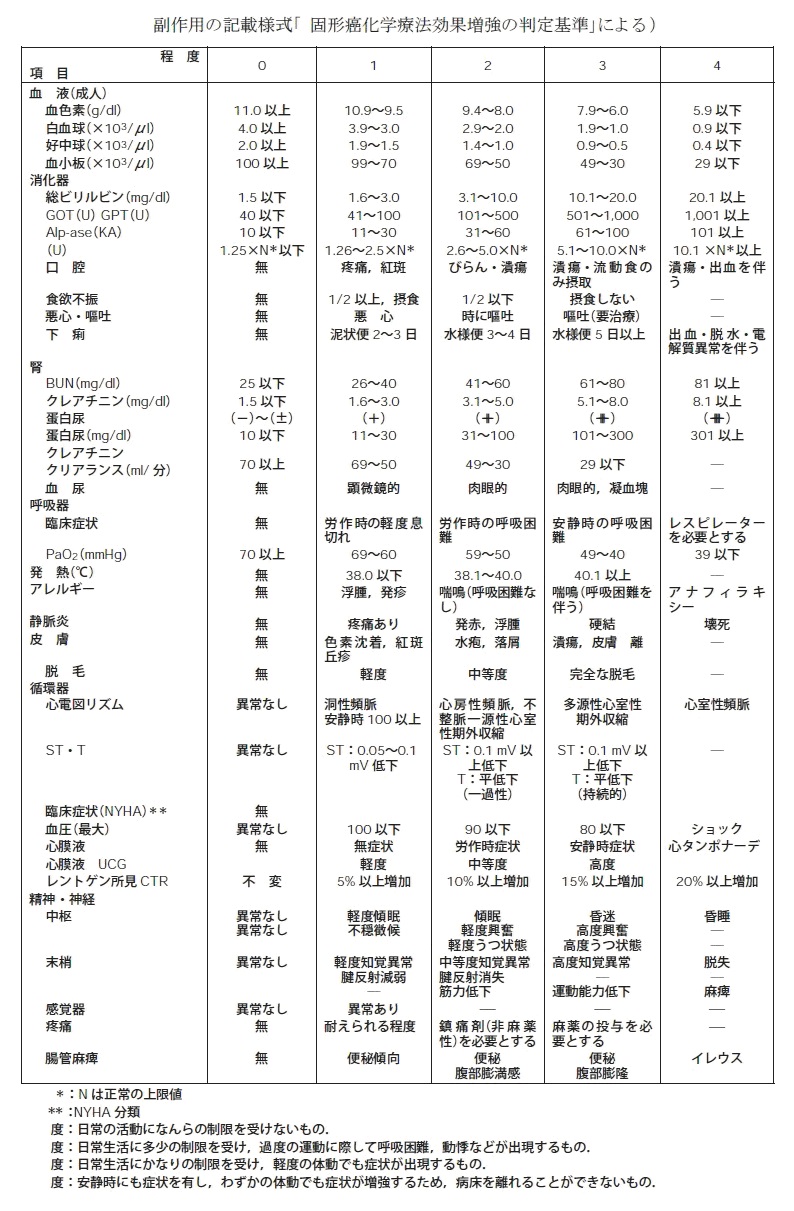
QOLの評価質問表(抗がん剤副作用)固形癌
RAGE(Rceptor for Advanced Glycation Endoproducts)
生体内糖化反応(グリケーション)AGEs(Advanced Glycation Endoproducts糖化最終産物)
糖化反応(glycation)は1912年にLC Maillardがアミノ酸と還元糖を加熱すると褐色の色素が生成することを発見したことから、メイラード反応として知られるようになった。発見以来、糖化反応は食品の加熱中に起こる着色や、香り・風味の変化、保存期間中の栄養価低下に関わる反応であることから食品化学の領域で注目されてきた。
1960年代になると、生体反応としてタンパク質糖化反応が注目されるようになり、その代表的な生成物としてヘモグロビンA1c(HbA1c)が血糖コントロール指標として糖尿病治療領域で臨床応用されるようになった。
また
糖尿病では様々なタンパク質糖化反応生成物が合併症の進展に関与していることが明らかになり、病態生理の解明・予防・治療への研究が展開されている。
さらに近年、
糖化反応は老化現象、認知症、癌、高血圧、動脈硬化症などにも関与していることが明らかになり、食品、糖尿病以外の新たな分野でも研究展開されている。
RAGE(Rceptor for Advanced Glycation Endoproducts:糖化最終産物受容体)
AGE化したタンパク質(AGE修飾タンパク)をリガンドとして認識するAGE受容体(
RAGE)の存在が知られている。
細胞はAGE修飾タンパクとAGE受容体の結合を引き金にして、サイトカインや成長因子の産生亢進など種々の細胞応答を引き起こし、糖尿病血管合併症をはじめとする種々の疾患発症・進展へと向かうことが考えられている。
現在、AGE受容体としては、ガレクチン3(galectin-3)、RAGE(receptor for AGEs)、SR-A、CD36、SR-BI、LOX-1、FEEL-1およびFEEL-2の7つが知られている(図)。
図. AGE受容体の種類
SR-A, CD36, SR-BI, LOX-1はスカベンジャー受容体ファミリーに属する
(高木ら,AGEs研究の最前線(メディカルレビュー社)より)
1990年代以降、抗AGE抗体を用いた免疫学的研究によって、AGE修飾タンパクが糖尿病性血管合併症、動脈硬化、アルツハイマー病など、多くの疾患病変部に沈着していることが確認された。
これら病変部でのAGEs蓄積が、その病気の直接因子なのか、単に病態の結果を反映しているのかは今もなお明確になっていないが、多くの研究がAGE受容体との反応が病変の発症・進展に必須な役割を果たしているという視点から展開している。
AGE受容体に関する研究では、病変部における病態発症へと導く詳細なメカニズムや、生体内AGEsをトラップして無毒化するメカニズムなど、未解明な課題があり今後の機能解析が期待される。
Rb遺伝子
癌抑制遺伝子の一つであり、網膜芽細胞腫の原因遺伝子として初めて発見された。
細胞周期がS期へ移行するのを抑制しているほか、現在では多くの
癌の発症に関与していることが分かっています。
Rb遺伝子産物(Rbタンパク質)は
細胞周期の調節に関与しており、
G1期における細胞周期の回転を抑制します。
S100タンパク質
S100 タンパク質は、EFハンド型カルシウム結合性ドメイン(loop-helix-loop)をもつ、分子量が8~14kD程度の低分子量のタンパク質群である。B.W. Mooreにより、1965年にウシ脳から分離された。現在までに20種類以上のサブファミリーが同定されている。
S100という名称は「中性硫酸アンモニウムに完全に(100%)溶ける(Soluble)」という特性に由来している。
現在のところS100A1~S100A18、S100B、S100P、S100Z、Calbindin D9k (S100G)、Profilaggrin、Trychohyalin、Repetinに分類される。
S100Bは特に脳での発現が高いことが知られている。
哺乳類の中枢神経系では、グリア細胞の一種であるアストロサイトに選択的に発現する。末梢神経系ではグリア細胞のシュワン細胞に発現する。
S100タンパク質群の機能は、細胞内カルシウム濃度を一定に保つバッファーとしての機能以外にも多岐にまたがると考えられており、未解明な部分が多い。
またS100タンパク質は細胞内のシグナル伝達のみならず、細胞外にも分泌される事が知られており、実際に血漿や脳脊髄液からも検出される。
培養細胞系では、
細胞外のS100Bは神経細胞の生存にかかわる栄養因子として働くことが提唱されている。
分布:S100タンパク質は、その種類により生体内での局在様式が異なる。
例えばS100A1は平滑筋の細胞質にある一方、100A2は平滑筋の核内に存在する。
S100Pは胎盤の発現が高い。
S100Bは脳での発現が顕著に認められ、中でもグリア細胞の一種であるアストロサイトに選択的に発現する。
S100Bはアストロサイトにより分泌され、細胞外空間や血中に拡散する。
脳損傷および炎症にて、血清中S100B濃度は高くなり、S100Bの血清濃度は神経疾患の一次的な診断材料となる。
血清中S100B濃度は、てんかんおよび統合失調症患者では高くなる。
また、
S100B濃度の上昇は、血液脳関門の損傷をも示唆し、診断ツールとしての有用性が広く認められている。
機能:S100タンパク質群は、
カルシウムホメオスタシス、タンパク質のリン酸化の調節(例:P53やTauタンパク質のリン酸化の阻害、タンパク質リン酸化酵素活性)、細胞成長、細胞運動性、細胞周期調節、翻訳、細胞分化、細胞生存など、多様な機能をもつことが提唱されている。
また、様々な疾患に関係するとされており、
乳がんやメラノーマを含む様々な癌細胞に発現する。
また、S100タンパク質は、炎症マーカーとしても利用される。
S100Bは、神経突起および軸索成長、メラノーマ細胞増殖、プロテインキナーゼC依存的なリン酸化、微小管の重合に関与しているとされている。
また、培養神経細胞を使用した実験では、神経細胞生存に重要であるという報告もある。しかし、S100Bノックアウト動物の神経回路形成には重篤な欠損がないことから、神経栄養因子としての機能は限定的であるという可能性も否めない。
細胞外でのS100Bの標的としては終末糖化産物受容体(RAGE)が知られている。
マウスを使用した実験で、S100Bの分泌は神経活動依存的に起こり、脳波活動に影響をもたらすことが報告されている。
SALL4
SALL4 は、ヒト胎児の肝臓で発現している
癌胎児タンパクであり、成人の肝臓ではサイレンシングされているが、肝細胞癌で予後不良な患者のサブグループでは再発現している。
遺伝子発現解析では、SALL4 陽性肝細胞癌では、増殖性遺伝子と転移性遺伝子を過剰発現している前駆細胞様の遺伝子特性の集積がみられた。
機能喪失解析では、
SALL4 が細胞生存と発癌に重要な役割を果たしていることが確認された。
in vivo 異種移植モデルで SALL4 とコリプレッサー(補助因子)の相互作用を遮断すると、PTEN(ホスファターゼ・テンシンホモログタンパク)による抑制が開始され、腫瘍形成が阻害された。
SCC(扁平上皮癌関連抗原、squamous cell carucinoma-related antigen)
SCCは扁平上皮癌細胞から抽出された抗原で、腺癌や未分化癌で陽性率は低いが扁平上皮癌では高い陽性率を示す。
血中SCCは
子宮頚部、肺、食道、皮膚の扁平上皮癌で高値を示し、扁平上皮癌の診断や治療効果の判定に利用されます。
SIRS(systemic inflammatory response syndrome:
全身性炎症反応症候群)
各種の侵襲によって誘引された全身性の急性炎症反応による症候。
致命的な多臓器不全状態の前段階として、非常に重要な概念である。
SIRSの本質は、侵襲に対応して免疫細胞が血中に放出した大量の炎症性サイトカインによる全身性の急性炎症反応である。
SIRSを誘発しうる侵襲としては、細菌感染のほかに、外傷や手術、出血性ショック、熱傷、膵炎などがある。
SIRSは、Secondary MOFに発展しうるという点で、非常に重要である。
多臓器不全(MOF)は往々にして致命的な転帰をたどることから、SIRSの段階で集中治療を行ない、多臓器不全状態への発展を阻止することが求められる。
なお、
SIRSが炎症性サイトカインによって引き起こされるのに対し、抗炎症性サイトカインによって免疫不全状態が引き起される代償性抗炎症性反応症候群(CARS)という概念も登場している。
生体内においては、SIRSとCARSが混合した、MARSと呼ばれる状態であることが多い。
SMC1
SMCタンパク質とは、染色体の高次構造と機能の制御に関わるATPアーゼファミリー、あるいはそれに属するタンパク質の総称。
SMC は、染色体構造維持(Structural Maintenance of Chromosomes)の略。
真核生物の SMC タンパク質は、6つのサブファミリー(SMC1- SMC6)に分類され、常にヘテロ2量体を形成する。
例えば、SMC1とSMC3のペアは姉妹染色分体の接着に関わるコヒーシン複合体のコアサブユニットを構成し、
SMC2とSMC4のペアは染色体凝縮に関わるコンデンシン複合体の一部として機能する。
残りの SMC5とSMCはDNA修復と染色体分離に関与する。
STAT3 (signal tranducer and activator of transcription 3)
分子内に、特異的リン酸化チロシン構造を認識するSH2 (src homology 2)ドメインを有し、gp130細胞内領域リン酸化チロシンを特異的に認識し、gp130上に運ばれてくると考えられ、JAKによりチロシンリン酸化される。
チロシンリン酸化されたSTAT3は、自身のSH2ドメインを介してSTAT3二量体(homodimer)あるいはSTAT1との二量体(heterodimer)を形成し、核内へ移行し、特異的DNA配列を認識して結合し、多くの遺伝子の転写を制御していることが知られている。
Streptococcus(ストレプトコッカス)
真正細菌の一属。
グラム陽性菌で通性嫌気性または偏性嫌気性の球菌。
乳酸菌の仲間でレンサ球菌の正式名称です。
一つ一つの球菌が規則的に、直鎖状に配列して増殖します。
ヒトや動物の口腔や腸内に多く住んでいます。
代表的な菌
・S. サリバリウス
・S. ミュータンス(S. mutans) 虫歯菌
・S. ミレリ(S. milleri)
TGF-β(トランスフォーミング増殖因子β)
トランスフォーミング増殖因子βは、様々な癌によって分泌される免疫抑制性 サイトカインで、細胞増殖、成長、分化 や運動性を調節します。
上皮間葉転換とTGF-β
消化管や肺の気道などの管腔は1層の上皮細胞という細胞によって覆われていて、80%以上の癌はこの上皮細胞から起こると言われています。
上皮細胞はさまざまな刺激で間葉系細胞と呼ばれる細胞に分化し、これを上皮間葉転換(EMT)と呼びます。
EMTはさまざまな刺激のなかでもTGF-βが上皮細胞に作用するとEMTが起こりやすくなります。
EMTを起こすと、細胞間の接着性が低下し、その細胞間をすり抜けて癌細胞が浸潤や転移をするのです。
癌細胞の浸潤は組織の破壊と再編を伴っており、そこにはプロテアーゼが関与しています。
実際に、癌組織では様々な細胞外プロテアーゼの過剰発現や活性の亢進が認められています。
このことから考えると、これらのプロテアーゼ活性を抑制してやれば、癌の転移や浸潤を防ぐ事ができると考えられます。
転移や浸潤に一番関与しているプロテアーゼは、マトリクメタロプロテアーゼ(MMP)です。
日本冬虫夏草ミジンイモムシタケは、マトリクメタロプロテアーゼの阻害効果が確認されています。
血管新生とTGF-β
癌の組織は、癌細胞とこれを取り巻く様々な細胞から成り立っています。
なかでも血管の働きは重要で、血管が癌の組織に侵入してくると癌細胞に酸素や栄養分が送られるだけでなく、入ってきた血管に癌細胞が入り込んで遠くの臓器に転移して行くためのルートともなることから、癌組織における血管新生を抑えることで癌の進展を抑制することができると考えられています。
しかし、スキルス胃癌の場合TGF-βの作用を遮断するとトロンボスポンジンという血管新生を抑えるタンパク質が作られなくなり、その結果血管新生が強く見られ、癌の増殖が促進されることがわかりました。
このことからスキルス胃癌ではTGF-βはむしろ善玉タンパク質として働いており、TGF-βの作用を増強させたり、血管新生を抑えたりすることでスキルス胃癌の進展を抑えることができる可能性が示されました。
癌幹細胞とTGF-β
脳腫瘍幹細胞ではTGF-βは癌幹細胞としての性質を維持する上で重要で、TGF-βの作用を遮断すると癌幹細胞が分化した細胞となることがわかりました。
TGF-βはここでは悪玉タンパク質として働いていることになります。
一方スキルス胃癌では、脳腫瘍幹細胞とは逆にスキルス胃癌幹細胞は、TGF-βを加えるとその数が減少することが分かりました。
このことは、癌の種類によってTGF-βの癌幹細胞に対する作用が大きく異なることがわかりました。
TGF-βは癌によって善玉にも悪玉にもなる
TGF-βの作用は複雑で癌の進行にとっては時には悪玉タンパク質となり、時には善玉タンパク質となります。
「癌には個性がある」とは古くから言われていますが、TGF-βは癌の個性によって善玉になったり悪玉になったりします。
Th17細胞
Th17細胞とは、免疫システムにおけるヘルパーT細胞の一種で、特に
病原細菌やカビ類に対する感染防御に極めて重要な役割を果たしていることが知られている。
一方でその
過剰応答が、慢性関節リウマチやクローン病、潰瘍性大腸炎などの自己免疫疾患に深く寄与していて、近年、これら疾患の発症メカニズムの解明と治療の観点からも非常に注目されている細胞です。
通常、Th17細胞は腸管だけに存在しているが、2009年に梅崎・本田博士らによって、セグメント細菌(SFB)が腸管のTh17細胞を特異的に誘導することが発見された(論文Cell,139:485-98)。
Th17細胞は、細菌や真菌に対する感染防御に役立っているが、一方でその行き過ぎた応答が自己免疫疾患である慢性関節リウマチやクローン病・潰瘍性大腸炎などに関わることが知られている。
したがって、腸内のセグメント細菌の働きをコントロールできれば、感染症や自己免疫疾患の予防や治療に役立つ可能性が考えられる。
TGF-βは癌によって善玉にも悪玉にもなる
TGF-βの作用は複雑で癌の進行にとっては時には悪玉タンパク質となり、時には善玉タンパク質となります。
「癌には個性がある」とは古くから言われていますが、TGF-βは癌の個性によって善玉になったり悪玉になったりします。
TIM-3(免疫チェックポイントたんぱく質)
TIM-3(T-cell immunoglobulin and mucin containing protein-3)免疫グロブリンスーパーファミリーに属する膜タンパク質で、CD4陽性Th1細胞あるいはCD8陽性T細胞に発現し、
ガレクチン-9(galectin-9)、phosphatidylserie(PtdSer)、
CEACAM-1、および
high mobility group box-1(HMGB1)の4つのリガンドと結合することが報告されています。
これらのうち、galectin-9およびCEACAM-1はCD8陽性T細胞制御に、HMGB1およびPtdSerは自然免疫システムに関与することが知られています。
このTIM-3シグナルを抗TIM-3抗体により阻害することにより抗腫瘍免疫応答を増強できることがマウスにおいて実証されており、現在、ヒトへの応用が試みられています。
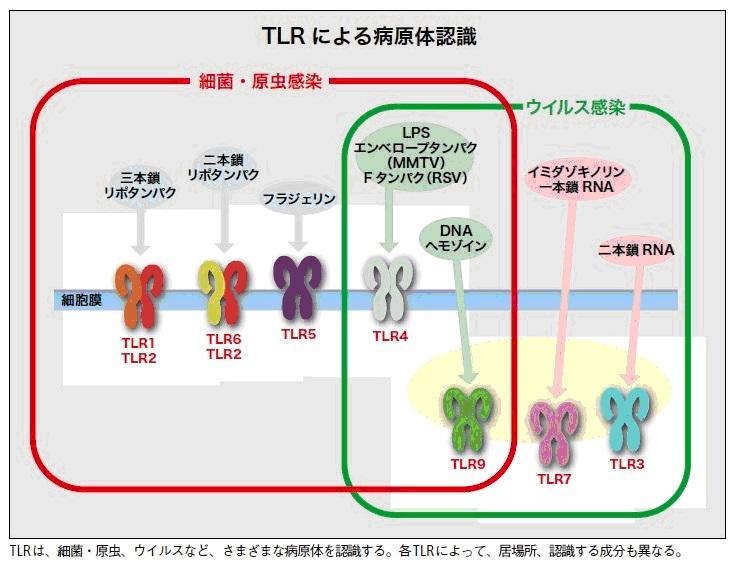
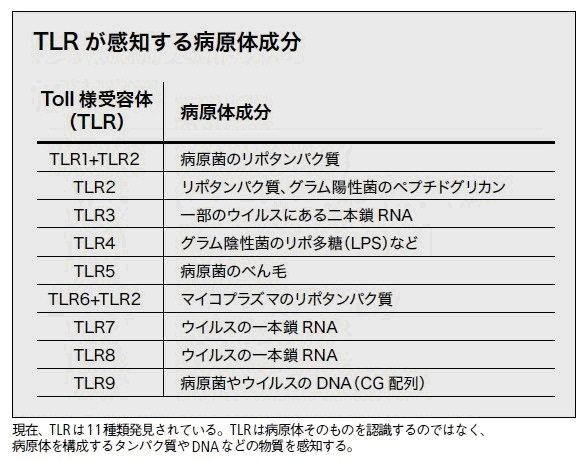
TLR(Toll様受容体Toll-like receptor:TLR)
動物の細胞表面にある受容体タンパク質で、
種々の病原体を感知して自然免疫(獲得免疫と異なり、一般の病原体を排除する非特異的な免疫作用)を作動させる機能がある。
脊椎動物では、獲得免疫が働くためにもToll様受容体などを介した自然免疫の作動が必要である。
TLRまたはTLR類似の遺伝子は、哺乳類やその他の脊椎動物(インターロイキン1受容体も含む)、また昆虫などにもあり、最近では植物にも類似のものが見つかっていて、進化的起源はディフェンシン(細胞の出す抗菌性ペプチド)などと並び非常に古いと思われる。
さらにTLRの一部分にだけ
相同性を示すタンパク質(RP105など)もある。
TLRやその他の自然免疫に関わる受容体は、病原体に常に存在し(進化上保存されたもの)、しかも病原体に特異的な(宿主にはない)パターンを認識するものでなければならない。そのために
TLRは、細菌表面のリポ多糖(LPS)、リポタンパク質、べん毛のフラジェリン、ウイルスの二本鎖RNA、細菌やウイルスのDNAに含まれる非メチル化CpGアイランド(宿主のCpG配列はメチル化されているので区別できる)などを認識するようにできている。
TLRは特定の分子を認識するのでなく、一群の分子を認識するので、パターン認識受容体という言い方もされる。
TLRの機能は知られているすべての生物で似ているため、基本的には同一モデルで説明できる(ただし少なくとも昆虫では活性化の様式が異なる)。
各TLRは、病原体のもつ特異的分子(または分子の特異的な組合せ)により活性化されて二量体を形成することで機能する。
多くのTLRはホモ二量体(同種分子からなる)として働くが、TLR2はTLR1やTLR6との間でヘテロ二量体をつくり、これらは互いに特異性が異なる。
またTLRは完全な機能を得るのに他の補助因子が必要なこともあり、この例としては
TLR4がある。
全てのLPSの認識にはMD-2が必要であり、CD14とLPS結合タンパク質(LBP)はLPSのMD-2への提示を促進することが知られている。
このようにして
活性化されたTLRは、細胞内シグナル伝達経路を介して、転写因子であるIRFやNF-κBを活性化し、それぞれIFN-α、IFN-βまたは、IL-1、IL-6、IL-8などサイトカインを誘導し、獲得免疫、あるいは炎症を誘導する。
細菌は、ファゴサイトーシスで取り込まれて消化され、その抗原はヘルパーT細胞(CD4+ T細胞)に呈示される。
ウイルス因子に対しては、インターフェロン(抗ウイルス活性をもつサイトカイン)を産生する。
感染細胞はタンパク質産生を中止し、アポトーシスに至る。
TNF-α
腫瘍壊死因子(Tumor Necrosis Factor, TNF)は、サイトカインの一種であり、狭義にはTNFはTNF-α、TNF-β(リンホトキシン(LT)-α)およびLT-βの3種類である。
TNF-αは主にマクロファージにより産生され、固形がんに対して出血性の壊死を生じさせるサイトカインとして発見された。
腫瘍壊死因子といえば一般にTNF-αを指していることが多い。これらの分子は同一の受容体を介して作用し、類似した生理作用を有する。
TNF-αは主に
活性化されたマクロファージによって産生される他、単球、T細胞やNK細胞、平滑筋細胞、脂肪細胞も産生源となる。
TNF-αは
細胞接着分子の発現やアポトーシスの誘導、炎症メディエーター(IL-1、IL-6、プロスタグランジンE2など)や形質細胞による抗体産生の亢進を行うことにより感染防御
や抗腫瘍作用に関与するが、過剰な発現は関節リウマチ,乾癬などの疾患の発症を招く。
TPA(組織ポリペプチド抗原、tissue polypeptide antigen)
TPAは細胞内の骨格を構成している構造たんぱく質であり、正常組織にも広く分布しているため、特異性の低い腫瘍マーカーです。
血中TPAは多くの悪性腫瘍で陽性を示すが、反面良性疾患における疑陽性率も高い。
しかし、癌の進行度に関連して測定値が増減するため、
治療効果の判定や再発の予知などに用いられます。
Treg細胞(制御性T細胞・調節性T細胞)
免疫応答の抑制的制御(免疫寛容)を司るT細胞の一種。
免疫応答機構の過剰な免疫応答を抑制するためのブレーキ(負の制御機構)や、免疫の恒常性維持で重要な役割を果たす。
制御性T細胞の発生には、
Foxp3誘導のほか、それとは別系統のTCR(T cell receptor)刺激によるDNAの配列変化を伴わない遺伝子機能の変化(エピジェネティクス参照)により、T細胞が制御性T細胞に分化すると考えられる。
分類・機能
免疫系の機能は自己と非自己を区別して非自己を排除することであり、免疫系の過剰な働きによって生じる自己反応性によって自己免疫疾患に陥る。
制御性T細胞は免疫系の崩壊を抑制し、免疫異常から生体を守っている。
また、Tregは自己免疫のみでなく炎症や腫瘍免疫、感染免疫などについても抑制作用を示すことが明らかになっている。
制御性T細胞が免疫抑制作用を発現するメカニズムは未だ十分に明らかになってはいないが、細胞同士の直接的な相互作用あるいは抑制的サイトカインであるTGF-βおよびIL-10の放出によると考えられている。
Tregのサブセットの代表的なものとしては以下のようなものが知られている。
内在性Treg
Foxp3+CD25+Treg
NKT細胞(Natural Killer T細胞)
CD8+CD122+Treg
誘導性Treg
Foxp3+Treg
タイプI Treg(Tr1)
Qa-1a拘束性CD8+Treg
発生・分化機構
胸腺で分化した新生T細胞は未熟な状態であり、CD4抗原もCD8抗原もなければ(ダブルネガティブ、DN)T細胞受容体(TCR)も有していない。
DN細胞はCD8+シングルポジティブ(SP)細胞を経てCD4+CD8+T細胞(ダブルポジティブ(DP)細胞)へと分化していく。
これらの過程中においてTCR遺伝子の再編成が行われ、TCRの多様性の形成が行われていくが、中には自己抗原に対して反応性を示すものも産生され自己免疫疾患に陥る可能性がある。
そのためこれらのクローンを除去するためにポジティブセレクションおよびネガティブセレクションと呼ばれる、いわば適切なT細胞のみを分化させるためにふるいにかけるようなことが行われる。
ポジティブセレクションは胸腺の皮質で行われ、CD4+CD8+T細胞の中から外来性抗原に対して反応性を持つTCRを有するものを選別する機構である。
一方、ネガティブセレクションとは自己抗原に対して反応性を持つ細胞を選別する反応であり、ネガティブセレクションを受けた細胞はアポトーシス(自発的細胞死)に導かれこの段階で通常脱落していく。
制御性T細胞もそのほかのT細胞と同様に独立した系列として胸腺内で分化していくと考えられている。
未成熟T細胞は胸腺上皮細胞による自己抗原の提示を受けてFoxp3を発現し、CD4+CD25+Tregへと分化が誘導されることが知られている。
Foxp3はIPEX(Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked)症候群患者およびscurfyマウスにおける自己免疫疾患の原因遺伝子として同定された。
Foxp3はFoxp3+CD25+Tregへの分化およびその機能に関与する遺伝子である。
一方、末梢においてもTGF-βの刺激を受けることによってFoxp3の発現が誘導されることが報告されており、IL-6とTGF-βの共刺激によってTh17細胞への分化が促進されてしまうためにTregへの分化は抑制される。
2012年2月10日
独立行政法人 理化学研究所
制御性T細胞はFoxp3発現を記憶する
-免疫疾患の新たな治療法開発を後押しできる成果-
ポイント
・制御性T細胞と「マスター転写因子」Foxp3の定説を覆す
・制御性T細胞にはFoxp3発現を記憶する潜在型がある
・Foxp3発現の記憶にはDNA脱メチル化が重要
要旨
独立行政法人理化学研究所(野依良治理事長)は、免疫応答を抑制する働きをもつ制御性T細胞が、さまざまな状況に置かれてもヘルパーT細胞へと分化せずに安定的に分化した状態を維持することを発見しました。
またその安定性を保つためにはFoxp3遺伝子のDNA脱メチル化が重要であることを突き止めました。
これは理研免疫・アレルギー科学総合研究センター(谷口克センター長)免疫恒常性研究ユニット堀昌平ユニットリーダーらを中心とする国際共同研究グループの成果です。
制御性T細胞は、自己免疫疾患やアレルギー疾患など過剰な免疫応答を抑制する働きがあり、この機能を利用した免疫疾患の治療法が世界中で研究されています。
これまで制御性T細胞は“マスター転写因子”であるFoxp3が特異的に発現し、その発生・分化と免疫抑制機能がコントロールされると考えられてきました。
一方、2009年に免疫恒常性研究ユニットらは、Foxp3を発現したT細胞※1(当時は制御性T細胞と解釈)がある環境下に置かれるとFoxp3の発現を失って免疫応答を促進するヘルパーT細胞へと分化することを報告しました。
制御性T細胞は体内で安定的に存在すると考えられてきましたが、この報告をきっかけに環境変化に対する制御性T細胞の安定性について論争が起きるとともに、制御性T細胞を用いた免疫疾患治療の有効性と安全性にも疑問を投げかけることになりました。
今回、研究グループは、マウスを用いてフェイトマッピング解析を行って、Foxp3を発現しているT細胞(Foxp3+ T細胞)がどのような細胞に分化するのかを調べました。
その結果、Foxp3+ T細胞は制御性T細胞のほかにも非制御性T細胞を少数含むことが分かり、ヘルパーT細胞に分化するのは制御性T細胞ではなくFoxp3を一過的に発現する非制御性T細胞であることを突き止めました。
また、一部の制御性T細胞は一過的にFoxp3の発現を失うものの、それらはFoxp3の発現を記憶しており、活性化によって再びFoxp3と免疫抑制活性を発現する“潜在型”制御性T細胞であることを見いだしました。
さらに、制御性T細胞はFoxp3遺伝子の発現制御領域をDNA脱メチル化することによってFoxp3の発現を記憶して安定に分化した状態を維持していることが分かりました。
今回の成果は、制御性T細胞の安定性に関する論争に決着をつけるとともに、さまざまな免疫疾患の治療に用いることができる制御性T細胞の作製・誘導に道を開くものと期待できます。本研究成果は、米国の科学雑誌『Immunity』オンライン版(2月9日付け:日本時間2月10日)に掲載されました。
背景
免疫系は、生体内に侵入した細菌やウイルスなどの病原体を認識して排除し、病気や感染から生体を守る高度なシステムです。
このシステムでは、多種多様な免疫細胞群がお互いに連携しながら働いていますが、その応答が過剰になると正常な細胞や組織まで攻撃してしまい、生体に悪影響を及ぼします。そのため免疫応答は、アクセルとブレーキ機能をバランス良く保つことが重要です。
制御性T細胞は免疫応答を抑える機能を持ち、自己免疫疾患、炎症性疾患、アレルギー疾患、移植片対宿主病や、移植臓器に対する拒絶反応などで起こっている過剰な免疫応答を抑制する重要な役割を担っています。
2003年に現免疫恒常性研究ユニットの堀ユニットリーダーらは、ヒト自己免疫疾患(IPEX症候群)の原因遺伝子として同定された転写因子Foxp3が制御性T細胞の“特異的な”分子マーカーであり、その発生・分化と免疫抑制機能を司る“マスター転写因子”であることを明らかにしました(Hori et al., Science, 2003)。
これまでの研究から制御性T細胞は安定にFoxp3を発現することでさまざまな状況に応じて免疫応答を抑制することができると考えられてきました。
そして、この広範で安定な免疫抑制機能を利用して、制御性T細胞を移植する免疫疾患治療法の試みが世界中で行われています。
その一方で、2009年に免疫恒常性研究ユニットらは、Foxp3を発現しているT細胞(Foxp3+ T細胞)を、T細胞を持たない変異マウスに移植した場合や、炎症環境下に置いた場合に一部がFoxp3の発現を失って免疫応答を促進するヘルパーT細胞へと分化することを見だしました(Komatsu et al., PNAS, 2009; Tsuji et al., Science, 2009)。
当時、この成果は、制御性T細胞がヘルパーT細胞に分化するという衝撃的な発見でした。その後、このFoxp3+ T細胞がヘルパーT細胞へ分化するという現象は、他の研究グループからも報告されましたが、それに対する反証も報告され、世界的に大きな論争を引き起こしました。
また、外的要因により制御性T細胞がヘルパーT細胞へ分化するならば、免疫疾患の治療のために用いた細胞が期待とは逆に疾患を悪化させることにつながりかねません。
ヘルパーT細胞が制御性T細胞に分化するという可能性は、制御性T細胞を用いた免疫疾患治療の有効性と安全性に疑問を投げかけるものでもありました。
そこで研究グループは、制御性T細胞の安定性を巡る論争に決着をつけるために、Foxp3+ T細胞の分化の仕組み解明に挑みました。
研究手法と成果
研究グループはフェイトマッピング解析と呼ばれる手法を正常なマウスに適用して、Foxp3の発現の有無と制御性T細胞の分化の関係性について調べました。
通常、T細胞は抗原と他の様々な因子によって活性化されることで、ヘルパーT細胞や制御性T細胞へ分化します。
この手法でFoxp3を現在発現している細胞を緑色蛍光タンパク質(GFP)で、一度でもFoxp3を発現した経験を持つ細胞を赤色蛍光タンパク質(RFP)でマーキングすることができます。
例えば、Foxp3+ T細胞がFoxp3の発現を失えば、それらの細胞はGFP-RFP+細胞として検出することができます。
この実験の結果、T細胞のうちFoxp3を発現しているT細胞(Foxp3+ T細胞)の約3~5%の細胞がGFP-RFP+であり、ヘルパーT細胞に分化することが分かりました。
次に、正常なマウスのFoxp3が発現していないT細胞(Foxp3- T細胞)を活性化することでFoxp3の発現の有無について調べました。
Foxp3-T細胞のなかから抗原に出会ったことのないナイーブT細胞だけを選別して活性化すると、約10%の細胞がFoxp3を発現することが分かりました。
しかも、このような活性化によって誘導されるFoxp3+ T細胞は、制御性T細胞とは異なった遺伝子発現を示すことや免疫抑制活性を有さないこと、またこのFoxp3の発現は不安定で、サイトカインなどのシグナルによって容易に失われることを発見しました。
つまり、Foxp3は制御性T細胞以外の通常のT細胞においても一過的に発現され得るという予想外の事実を発見しました。
さらに、Foxp3-T細胞の移植実験と上記のフェイトマッピング解析を用いた実験を行ったところ、Foxp3-T細胞を移植された細胞から免疫抑制活性を持たない不安定なFoxp3+T細胞(非制御性T細胞)が誘導され、T細胞欠損マウスや炎症環境下ではヘルパーT細胞はこれらからのみ分化することを見つけました。
一方、免疫抑制活性を示す制御性T細胞を同様の環境に置いてもヘルパーT細胞へ分化することはありませんでした。
そして、一部の制御性T細胞は一過的にFoxp3発現を失うものの、活性化させると再びFoxp3と免疫抑制機能を安定に発現するようになり、これらは“潜在型”制御性T細胞であることが分かりました。
つまり、制御性T細胞は、Foxp3発現を記憶していることが明らかになりました。。
そこで、制御性T細胞における頑健なFoxp3の発現と、免疫抑制機能を持たない非制御性T細胞の一過的なFoxp3の発現とでは何が異なるのかを調べました。
その結果、Foxp3遺伝子の発現制御領域のDNAメチル化状態が大きく異なることを見だしました。
制御性T細胞ではFoxp3発現の有無に関わらず、この領域が完全に脱メチル化されることで遺伝子が常に発現可能な状態に保たれているのに対し、一過的なFoxp3発現を示す非制御性T細胞では、Foxp3を発現するのにも関わらず完全にメチル化されており、遺伝子が不活性化状態であることがわかりました。
つまり、制御性T細胞におけるFoxp3発現の記憶はFoxp3遺伝子の発現制御領域のDNA脱メチル化によってコントロールされており、制御性T細胞はこの記憶のメカニズムによって安定に分化状態を維持していることが分かりました。
今後の期待
今回の成果は、ヘルパーT細胞は制御性T細胞から分化するのではなく、Foxp3を一過的に発現する非制御性T細胞から分化することが示されたように、Foxp3+ T細胞集団には様々な種類の細胞が含まれていることを証明し、制御性T細胞の安定性を巡る論争に決着をつけることができました。
また、制御性T細胞はさまざまな環境においてもFoxp3の発現を記憶して免疫抑制機能を発揮することが分かり、本成果は制御性T細胞を利用した免疫疾患治療法を科学的に後押しすることとなります。
またこれまでは、「Foxp3が制御性T細胞の“特異的”分子マーカーでありその“マスター転写因子”である」という過度に単純化された概念が主流でしたが、Foxp3が制御性T細胞の分化と関係なく発現し得るという発見は、これまでの学術界の定説を覆すものとなります。
今後は、頑健なFoxp3発現を誘導するメカニズムの解明を目指します。
将来的に安定な免疫抑制活性を備えた制御性T細胞を人為的に作製・誘導することが可能になれば、免疫疾患の治療に大きく貢献すると期待できます。
補足説明
1.制御性T細胞
ヘルパーT細胞、T細胞T細胞は、T細胞レセプターと呼ばれるタンパク質を細胞表面に持ち、このレセプターを介して異物を特異的に認識して活性化する。
T細胞はその働きから、 ウィルス感染細胞やがん細胞などを特異的に殺すキラーT細胞、B細胞やマクロファージ(食細胞)などほかの免疫細胞に働きかけてその機能を活性化するヘルパーT細胞に大きく分類されてきた。
さらに最近、T細胞には、ほかの免疫細胞(キラーT細胞、ヘルパーT細胞、B細胞、マクロファージなど)に働きかけて その活性化を抑制する機能を持つ制御性T細胞と呼ばれる新たな集団が存在することが明らかにされた。
制御性T細胞はリンパ組織中、T細胞の約5~10%を 占め、転写因子Foxp3の発現により、ほかのT細胞と区別されてきた。
しかし、
今回の研究成果によりFoxp3を発現していても制御性T細胞でない場合もあることが分かった。
2.DNA脱
メチル化遺伝子発現の制御様式の1つ。
DNAのCpGという配列でシトシンにメチル基が付加される修飾をDNAメチル化という。
遺伝子が発現されるか否かを制御している領域がメチル化されると、その遺伝子は不活性化されて発現されなくなる。
逆にメチル基が除去される過程を脱メチル化といい、不活性化されていた遺伝子が活性化され発現されるようになる。
3.マスター転写因子
特定の細胞種に分化するためには、その細胞特有の機能を発現するために必要な一群の遺伝子セットを発現することが必要である。
一般に遺伝子の発現は、遺伝子発現制御領域である特定のDNA配列に転写因子と呼ぶタンパク質が結合することで調節されている。
細胞分化に伴ってある特定の転写因子が遺伝子発現制御領域に結合することで、その細胞種に特有の遺伝子セットの発現がオンになると考えられ、そのような最初のスイッチとして機能する転写因子をマスター転写因子と呼ぶ。
4.Foxp3
ヒトの遺伝性免疫疾患IPEX症候群の原因遺伝子として2001年にワシントン大学のChatilaら、ワシントン州立大学のBennett ら、オレゴン保健科学大学のWildinらの研究チームが報告した転写因子。2003年に堀昌平ユニットリーダーらにより、この転写因子が制御性T細胞に 発現する特異的な分子マーカーで、その分化と機能を制御するマスター転写因子であることが明らかとなった(Hori et al. Science 299: 1057-1061, 2003)。
しかし、今回の研究成果により、このような過度に単純化された概念に修正が加えられることになった。
5.フェイトマッピング解析
特殊な部位特異的遺伝子組換えの原理を使って、ある特定の遺伝子を発現した経験を持つ細胞を永久的に蛍光タンパク質などのマーカー分子で標識して、その細胞の挙動を追跡する解析手法。
この手法により、目的の遺伝子を一過的に発現してその後発現を消失してしまった細胞をマーキングすることができる。詳細はを参照。
6.ヒト自己免疫疾患(IPEX症候群)Immune dysregulation, Polyendocrinopathy, Enteropathy, X-linked(X染色体連鎖型免疫調節異常・多発性内分泌障害・腸症)症候群の略。
X染色体連鎖型劣性の遺伝様式を示し、変異を受け継いだ男子だけが致死性の自己免疫性・炎症性・アレルギー性免疫疾患を発症する。
膵臓、甲状腺、大腸、皮膚などさまざまな臓器に炎症・組織破壊が起こり、患者は通常生後1、2年以内に死亡する。
2001年にワシントン大学のChatilaら、ワシントン州立大学のBennettら、オレゴン保健科学大学のWildinらの研究チームがこの遺伝性免疫疾患の原因遺伝子を同定し、転写因子Foxp3であることを報告した。

フェイトマッピング解析について
(A)この手法は、Cre-loxP部位特異的組換え※を利用する。
まず、Foxp3遺伝子にGFP-Cre融合タンパク質遺伝子を導入した遺伝子改変マウス(a)を作製。
また、全身で常に発現するROSA26遺伝子にloxP配列で挟んだSTOPカセットとRFPタンパク質遺伝子を導入した遺伝子改変マウス(b)を共同研究者より入手した。
次に(a)と(b)を交配させる。
すると、Foxp3遺伝子が発現した場合、GFP-Cre融合タンパク質遺伝子も発現し、緑色の蛍光を発すると同時にCreがloxP配列を認識してSTOPカセットを部位特異的組換えにより除去して、RFPタンパク質が発現する。(GFP+RFP+)
また、Foxp3遺伝子が発現しない場合、GFP-Cre融合タンパク質遺伝子も発現しないので、CreがloxP配列を認識できず、STOPカセットの作用でRFPタンパク質遺伝子は発現しない。
(GFP-RFP-)過去にFoxp3遺伝子が発現したが消滅した場合は、ROSA26遺伝子は常に発現するためRFPは発現し続ける。(GFP-RFP+)
(B)T細胞でFoxp3遺伝子発現を誘導すると、GFPによって緑色の蛍光を発し、さらにRFPによって赤色の蛍光を発する。
Foxp3遺伝子を消失させると、赤色の蛍光だけが残る。
(C)このマウスのリンパ節を解析するとGFP-RFP+ T細胞が3-5%存在することがわかり(赤枠)、Foxp3発現を消失したT細胞が存在することがわかる。
※Cre-loxP部位特異的組換え バクテリオファージ研究で見出された部位特異的組換え反応。
loxPという特定のDNA配列を標的としており、DNA組換え酵素Creにより触媒される。
現在では条件的遺伝子ノックアウトを実施する目的などで広く使われる技術。
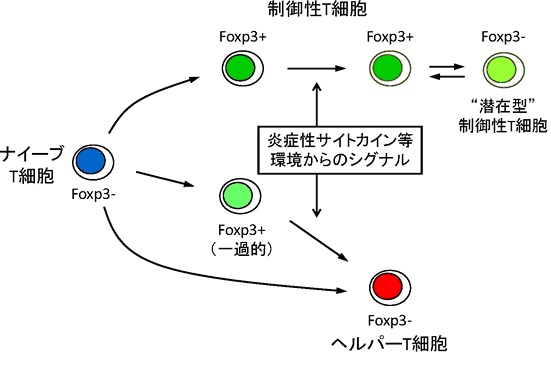
ナイーブT細胞の活性化に伴う一過的なFoxp3の発現
Foxp3-ナイーブT細胞が活性化する際、一部の細胞が免疫抑制機能を獲得することなく一過的にFoxp3を発現する。
この活性化によって誘導されるFoxp3の発現は不安定であり、炎症性サイトカイン(炎症を引き起こす物質)などの外部からのシグナルに応じて容易に失われる。
一方、制御性T細胞におけるFoxp3発現は頑健であり、さまざまな外的シグナルに対しても安定にFoxp3を発現して制御性T細胞として維持することができる。
そして、一部の制御性T細胞は一過的にFoxp3発現を失うものの、活性化によって再度Foxp3を発現し免疫抑制機能を発揮する(“潜在型”制御性T細胞)。
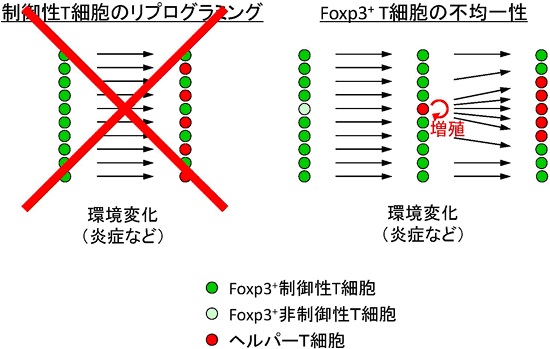
Foxp3+ T細胞集団には制御性T細胞と非制御性T細胞が存在する
ヘルパーT細胞は制御性T細胞から分化するのではなく、Foxp3を一過的に発現する非制御性T細胞から分化することが示された。
Foxp3+ T細胞集団は制御性T細胞の他にも少数だが非制御性T細胞を含むことが分かった。非制御性T細胞は、様々な外的要因に対してFoxp3を消失することでヘルパーT細胞へ分化し、炎症などの環境下では選択的に増殖することで蓄積する。
一方、制御性T細胞の分化状態は安定であり、外的要因に対しても安定にFoxp3を発現して制御性T細胞として維持できる。
▼ PQRST先頭へ