KLMNO
KLF5(Kruppel-like factor 5)
KLFは、
zincフィンガー型転写因子ファミリー(KLF)と呼ばれ、現在17種類が知られている転写因子群です。
KLF4はiPS細胞の誘導因子の一つである。
KLFは特徴的な構造を持った転写因子群であり、
個体の発生、細胞分化あるいは癌を含む病態の形成に重要であることが知られています。
平滑筋細胞が形質変換を起こしたときに発現が増える胎児型平滑筋ミオシン重鎖遺伝子SMembの解析から(論文Biochem Biophys Res Commun. 1997;239:598-605)、この遺伝子の発現を制御する転写因子として同定したのがKLF5/BTEB2です(論文Circ Res. 1999;85:182-191)。
KLF5は血管の組織構築を改変するのに重要なPDGF-Aなどのパラクライン因子の発現を制御するとともに、平滑筋形質変換を制御して病変形成を調節していると考えられます(論文Circ Res. 2005;97:1132-1141)。
KLF5はストレス応答と細胞内代謝を制御することにより、多様な細胞において病態の基盤となる分子機構を制御している可能性が高い。
KLF5ヘテロ接合体ノックアウトマウスでは、各種の負荷による心臓の肥大や線維化も減弱しており、血管だけでなく心臓の組織構築の改変(リモデリング)に重要であることが明らかとなっています。
代謝疾患におけるKLF5
KLF5が脂肪細胞の分化を制御する転写因子ネットワークの重要な構成要素であることを見つけ出しました(Cell Metab. 2005;1:27-39)。
心血管系の病気で重要な鍵分子として見つけ出したKLF5が代謝組織でも重要なことがわかりました。
KLF5がさらに成体でも代謝ストレスに対する応答に重要であることを見いだしています。
肥満やメタボリックシンドロームを背景とする血管と代謝組織の変化には多くの共通点があります。
KLF5が血管と代謝組織の両方で機能して、メタボリックシンドロームにおいて血管と代謝組織の両方で同時に病気を進める重要な因子であると考えています。
KLF5が骨格筋において脂肪酸燃焼や脱共役に関わる遺伝子群の発現を制御していることが分かりました。
さらに、一種の翻訳後修飾であるSUMO化を受けたKLF5がこれらの遺伝子の発現を抑制すること、PPARdeltaリガンドの作用でSUMOが外れ、脱SUMO化したKLF5は今度は遺伝子の発現に必要であることが分かりました。
つまり、KLF5のSUMO化が脂肪酸燃焼の分子スイッチのように働くことが分かりました。
慢性腎臓病におけるKLF5
慢性腎臓病(CKD)は、透析が必要な慢性腎不全の原因となるだけでなく、心不全や脳梗塞などの様々な生活習慣病のリスクとなるとともに、予後に大きく影響することが分かってきています。
そのため、CKDのメカニズムを明らかにし、新たな予防法・治療法を開発することが強く求められています。
疾病構造の変化に伴い、最近では透析の原因となる原疾患は、糖尿病や高血圧が増加しています。
このようなCKD の原因疾患の変化とともに、その発症機序については慢性炎症が注目されるようになっています。
尿細管間質領域の障害がfinal common pathwayとしてCKDの予後を規定する最重要な要因であることが知られていますが、尿細管間質領域の障害を生じる主要なメカニズムが慢性炎症で、線維化や尿細管の破壊などの組織構築のリモデリングを引き起こします。
腎臓に障害が与えられると、集合管上皮でKLF5はS100A8とS100A9の発現を誘導すること、誘導されたS100A8/S100A9は腎臓にM1型マクロファージを集積させることが分かりました。M1型マクロファージは各種の炎症性サイトカインを分泌することによって、組織の破壊を進めるとともに、炎症を促進すると考えられます。時間がたつと、KLF5とS100の発現は低下し、マクロファージはM2型という性質を示すようになります。
このM2型マクロファージは腎臓の線維化を進めることが分かりました。
このように、集合管は腎臓の傷害に対する応答に必須であること、腎臓の病態を進める上で、マクロファージの機能(活性化の極性、polarity)の変化が重要であること、KLF5はこれらのプロセスを制御する鍵分子であることが明確となりました。
このようにKLF5はメタボリックシンドローム、心血管病や慢性腎臓病で重要な働きをしているタンパクであることが明らかとなりました。
KLF5はこれらの疾患の治療法開発において魅力的な標的分子です。
All rights reserved by Ichiro Manabe, 2007-2013
東京大学大学院医学系研究科循環器内科 真鍋研究グループ
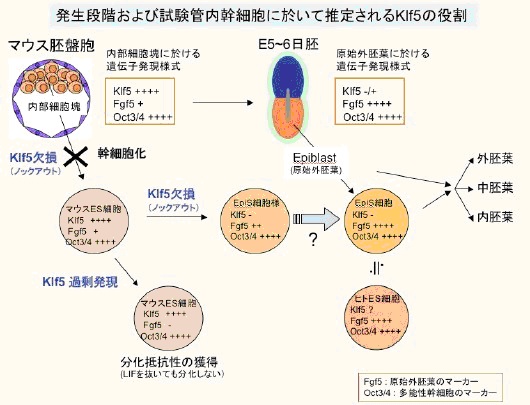
胚性幹(ES)細胞化や自己複製に関わる転写因子Klf5を同定
筑波大学・大学院 人間総合科学研究科の研究グループと理化学研究所の共同研究
2008年11月6日米国科学誌セルステムセルに掲載された。
Klf5が内部細胞塊からのES細胞樹立過程に必須であることを明らかにしました。
Klf5がES細胞の分化を抑制すると同時に増殖を促進することで、ES細胞の自己複製を制御していることを示すことができました。
一方iPS細胞誘導に用いられるKlf4は、ES細胞の分化を抑制する点に関してはKlf5と同様な機能を有するが、増殖に関しては抑制的に作用することが判明しました。
Klf5欠損ES細胞は、ヒトES細胞やEpiS細胞に部分的に類似した生物特性および遺伝子発現を示しました。
また、Klf5が胚の着床に極めて重要であり、欠損胚は早期に致死となることを示しました。
 zincフィンガースーパーファミリー
zincフィンガースーパーファミリー:タンパク質ドメインの大きなスーパーファミリーの1つで、DNAに結合する性質を持つ。
ジンクフィンガーは2つの逆平行βシートと1つのαヘリックスからなる。
小さすぎて疎水中心を持たないため亜鉛イオンが安定化にとって重要である。
KM01
KM01は、Lewis血液型物質に関連した癌糖鎖抗原です。
血中KM01は消化器系の癌で高い陽性率を示すが、なかでも
膵臓癌、胆道癌、肝臓癌で高値が認められます。
K-ras
H-ras、N-ras、K-rasのrasがん遺伝子とされるもののひとつで、現在
EGFR(上皮成長因子受容体)が出す細胞増殖のシグナルを核に伝達して、細胞増殖を進めるアクセルとしての機能を持つと考えられる。また、K-ras遺伝子の変異とがん化の促進に関係があると考えられている
K-rasと分子標的薬
大腸がんの治療薬セツキシマブ (Cetuximab) などの上皮成長因子受容体に結合してその働きを阻害することで効果を狙う分子標的薬では、KRAS遺伝子の変異が存在すると薬理効果が期待できない可能性が高いとの知見がある。
反面K-ras遺伝子の一部に変異があっても、肺がんの治療薬メトトレキサートやペメトレキセドなどの葉酸代謝拮抗薬は、がん細胞に遺伝子増幅が見られない非小細胞肺癌の患者には薬効が大きく期待できるとされている。
Lactobacillus属(ラクトバチルス属)
真正細菌の一属。
通性嫌気 嫌気性の桿菌。
乳酸菌の代表格。
乳酸のみを作る「ホモ型乳酸発酵」と、乳酸以外のものを同時に作る「ヘテロ型乳酸発酵」の2種類に分けられます。
自然界に広く存在し、腸内細菌の善玉菌としても活躍しています。
発酵食品に良く利用されていますが、一方で乳製品や醸造酒の変質の原因にもなります。
代表的な菌 :・L. アシドフィルス ・L. カゼイ L. カゼイ・シロタ ・L. サケイ
・L. プランタルム・L. デルブルッキー(L. delbrueckii) ・L. ブルガリクス
・L. ヨグルティ ・L. ヒルガルディ ・L. フルクチボランス ・L. ブレビス
NBS1
遺伝子の本体であるDNAの損傷(物理・化学的変化)が起き、これが様々な障害の原因となります。
放射線によるDNA損傷には、塩基損傷、DNA切断(一本鎖、二本鎖)などがありますが、通常起こるような少数のDNA損傷はほぼ全て修復されています。
その一方で、修復不能となったり、修復ミスが起きてしまうと、細胞死、突然変異、染色体異常、発がんなどの誘因となります。
細胞の中でDNAの損傷を修復するしくみはずいぶん明らかになってきましたが、未解明な点も多く残されています。
高発がん性の遺伝疾患である「ナイミーヘン症候群」に関わるNBS1というタンパク質です。NBS1というタンパク質は、通常は細胞核全体に分布していますが、
DNAに損傷が入ると損傷部に集合して修復や細胞応答を制御します。
放射線の修復タンパク質NBS1が損傷部に他の修復タンパク質を集合させるのに機能する部分をはじめ、NBS1が制御するDNA修復機構が損傷を正確に直すタイプの「相同組換え」という機構であることや、発がんを抑えるために有効なアポトーシスという細胞死の制御にも機能していることを明らかになった。
NCC-ST-439
NCC-ST-439はシアリル糖鎖抗原で、消化器系の腫瘍マーカーとして利用されます。
血中NCC-ST-439は
膵臓癌、胆道癌、大腸癌、乳癌などの多種類の腺癌で高値となります。
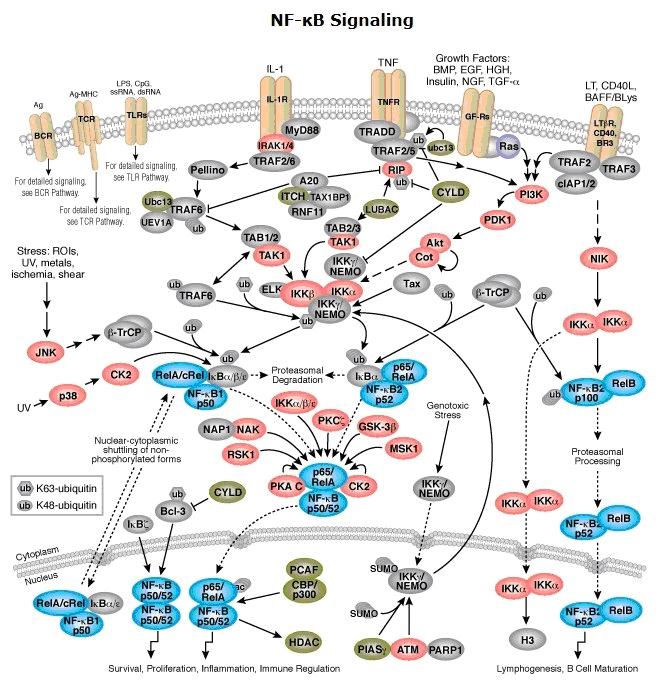
NF-κB(エヌエフ・カッパー・ビー 核内因子κB nuclear factor-kappa B)
転写因子として働くタンパク質複合体である。
NFκBは1986年にノーベル生理学医学賞受賞者であるデビッド・ボルティモアらにより発見された。
免疫グロブリンκ鎖遺伝子のエンハンサー領域に結合するタンパク質として発見され、当初はB細胞に特異的なものと考えられていたが、後に動物のほとんど全ての細胞に発現していることが明らかとなった。
高等生物に限らずショウジョウバエやウニなどの無脊椎動物の細胞においてもNF-κBが発現している。
NF-κBはストレスやサイトカイン、紫外線等の刺激により活性化される。
NF-κBは免疫反応において中心的役割を果たす転写因子の一つであり、急性および慢性炎症反応や細胞増殖、アポトーシスなどの数多くの生理現象に関与している。
NFκB活性制御の不良はクローン病や関節リウマチなどの炎症性疾患をはじめとし、癌や敗血症性ショックなどの原因となり、特に
悪性腫瘍では多くの場合NF-κBの恒常的活性化が認められる。さらにNF-κBはサイトメガロウイルス (CMV) やヒト免疫不全ウイルス (HIV) の増殖にも関与している。
NFκBパスウエイ
Nodファミリータンパク質(NLR)
(Nucleotide-binding domain and leucine rich repeat;NLR)
最近
apoptotic protease-activating factor (Apaf)-1と類似の構造をもつ20種類を越す蛋白質が発見され、それらが
炎症とアポトーシスの誘導や制御に働く分子であることが明らかになってきている。
これらの蛋白は分子中央に核酸結合領域(Nucleotide-binding domain)、カルボキシル末端にロイシンリッチ・リピート領域を持つことから、NLRファミリーと呼ばれている。
少なくとも一部のNLR蛋白は
トル様受容体(Toll様受容体(Toll-like receptor:TLR))のように病原体に特徴的な分子構造(
PAMP)を認識し、自然免疫の活性化に働いていると考えられている。
例えば、
Nod1とNod2は細菌ペプチドクリカンの部分構造を認識し、
NF-κBの活性化を誘導し、自然免疫系の活性化に働いている。
また、NALP3 (Cryopyrin, PYPAF1), NLRP1 (NALP1), NLRC4 (CARD12, Ipaf, CLAN)などはASCと呼ばれるアダプター蛋白と協働してカスパーゼ1を活性化し、IL-1β蛋白の成熟・分泌を誘導する。
ASCは細胞死やNF-κBの活性化に寄与する。
ASCを介するアポトーシスとNF-κBの活性化の両方にカスパーゼ8が重要な役割を果たしていることを発見した(Hasegawa et al. J. Biol. Chem. 2005)。
また、カスパーゼ1を発現する細胞では、ASCの活性化によってネクローシス様の細胞死が起きること、この時カスパーゼ1の蛋白分解酵素としての活性は必要ないことなどを明らかにした(Motani et al. J. Biol.Chem. 2011)。
NSE(神経特異エノラーゼ、neuron-specific enolase)
NSEは神経内分泌細胞に含有される解糖系の酵素であり、神経内分泌系の腫瘍マーカーとして用いられる。
血中NSEは
神経芽細胞腫や褐色細胞腫などの神経内分泌腫瘍や肺小細胞癌で高値を示す。
また、その治療効果の判定や経過観察にも有用です。
▼ KLMNO先頭へ