ハ行
胚盤胞(英: blastocyst)
卵割腔(en:blastocoel)形成後から着床前の胚形成(en:embryogenesis)初期に形成される構造のことである。
胚の次の形態は胚盤胞は内細胞塊(en:inner cell mass)あるいは胚結節を有し、胎盤に外細胞塊あるいは栄養膜(en:trophoblast)が形成される。
ヒトの胚盤胞は70-100個の細胞を含有する塊より生じる。
内細胞塊は身体のあらゆる細胞に分化する能力を有することが知られており、再生医療の分野で注目を浴びた。
この
細胞を取り出し、培養したものがいわゆるES細胞と呼ばれるものである。
一方、栄養膜は胎盤や羊膜などの胚外組織に分化していく。
胚葉
多細胞動物の初期胚において、卵割によって形成される多数の細胞が、しだいに規則的に配列してできる、各上皮的構造のことである。
卵割:受精卵の細胞分裂のことである。
受精卵は体細胞分裂により、まず胞胚という中空のボール状の細胞塊になる。
この表面の一部がくぼみ(原腸陥入)、陥入した部分は原腸となる。
この段階を原腸胚という。こうして細胞の外側と内側(原腸側)の違いができ、外側が外胚葉、内側が内胚葉の二胚葉となる。
この段階から器官形成に入るものを二胚葉性と言い、刺胞動物などはこれにあたる。
それ以外の動物ではこの二胚葉の間にさらに細胞塊を生じ、これを中胚葉という。
中胚葉を生じる動物を三胚葉性という。
パキテン期
減数分裂の過程
間期
第一分裂前期ー細糸期(レプトテン期)
第一分裂前期ー合糸期(ザイゴデン期)・厚糸期(パキテン期)
第一分裂前期ー複糸期(ディプロテン期)
第一分裂前期ー移動期(ディアキネシス期)
第一分裂中期
第一分裂後期
第一分裂終期I・中間期・第二分裂前期・第二分裂中期
第二分裂後期
第二分裂終期
バクテロイデス門
バクテロイデス門は、グラム陰性の細菌グループで、真正細菌の門の1つ。Cytophaga-Flavobacterium-Bacteroidetes (CFB) グループとも呼ばれる。
腸内細菌叢の主要な構成菌であり、海洋を中心とした水系、土壌などにも広く分布する。
系統的に近縁なクロロビウム門と合わせ、Bacteroidetes/Chlorobi グループ(FCB群)と呼ばれることがある。
バクテロイデス門は、真正細菌としてはやや大きめの門であり、プロテオバクテリア門に次いで一般的なグラム陰性菌になる。
バクテロイデス綱、フラボバクテリア綱、スフィンゴバクテリア綱の3綱に分類される場合が多い。
2008年現在、3つの綱の合計で約60の属が含まれている。
多くは桿菌またはらせん菌の形をとり、タンパク質や糖類を基質にして従属栄養的に増殖する。
細胞膜にスフィンゴ脂質を含むという特徴がある。バクテロイデス綱は嫌気性で、多くの動物の消化器官に分布し、ヒトの腸内細菌の中でも最も大きなグループを占めている。
人に対して病原性を持つ種は少ないが、日和見感染症を引き起こすことがある。
一方、フラボバクテリア綱、スフィンゴバクテリア綱は好気性菌が多く、水系、土壌から分離されることが多い。多くの種が黄色色素を産生する。
パターナリズム
医療の現場において見られる パターナリズム(medical paternalism)は、
「患者の最善の利益の決定の権利と責任は医師側にあり、 医師は自己の専門的判断を行なうべきで、 患者はすべて医師に委ねればよい。」
という考え方を指します。
いわば、医師は患者の父親もしくは指導者であり、 患者はその子供である。
というような医師と患者間の支配関係を指す言葉であり、 「医療父権主義」「医療パターナリズム」と呼ばれます。
パターナリズムは、 古くから医療の現場において長い間実践されてきたのですが、 近年の「患者の権利」意識の高まりとともに、 否定され、無くなりつつあります。
現在では、医師と患者を対等な関係とみなすのが、 一般的ですが、昔ながらの病院や診療所では、いまだに、パターナリズムが残っている所もあるようです。
それにしても昔は、医者にかかった時に、 治療法のことについて、あれこれ質問したりすると「患者は黙って医師の言うことを聞いていればいい!」と叱られたものでした。
ヒアルロニダーゼ阻害効果
ヒアルロン酸は哺乳動物の結合組織に広く存在するマトリックス成分の一種で、皮膚の保水、関節の潤滑など物理的な機能を果たしています。
通常、生体内では、ヒアルロン酸合成酵素と分解酵素の活性の平衡が保たれていますが、老化等に伴い分解酵素であるヒアルロニダーゼ活性が亢進すると、組織の柔軟性や潤滑性が失われ、関節の痛みや皮膚のしわ等の原因となります。
一方、ヒアルロニダーゼは起炎酵素としても知られており、炎症部位で活性の亢進が確認されていることや、がん細胞が血管新生を誘導する際に、ヒアルロニダーゼ活性が亢進することも報告されていることなどから、ヒアルロニダーゼ阻害は、老化に伴う変化や炎症の改善・予防剤、がんの転移抑制剤として期待されています。
また、アトピー性皮膚炎等による皮膚の炎症やそれに伴うかゆみの軽減・予防剤としても検討されています。
ヒアルロン酸
グリコサミノグリカン(ムコ多糖)の一種。学術上はヒアルロナン(英: Hyaluronan)と呼ぶ。
N-アセチルグルコサミンとグルクロン酸 (GlcNAcβ1-4GlcAβ1-3) の二糖単位が連結した構造をしている。
極めて高分子量であり、分子量は100万以上になると言われている。
コンドロイチン硫酸など他のグリコサミノグリカンと異なり、硫酸基の結合が見られず、またコアタンパク質と呼ばれる核となるタンパク質にも結合していない。
生体内では、関節、硝子体、皮膚、脳など広く生体内の細胞外マトリックスに見られる。とりわけ関節軟骨では、アグリカン、リンクタンパク質と非共有結合し、超高分子複合体を作って、軟骨の機能維持に極めて重要な役割をしている。
ある種の細菌も同様な構造を持つ糖鎖を合成している。
ヒアルロン酸は、悪性胸膜中皮腫の腫瘍マーカーであり、胸水でのヒアルロン酸の検出はこれを示唆する。
早老症において尿中ヒアルロン酸濃度が高くなる。
肝硬変では血清中のヒアルロン酸濃度が上昇する。
微小管
細胞中に見いだされる直径約 25 nm の管状の構造であり、主に
チューブリンと呼ばれるタンパク質からなる。細胞骨格の一種。
細胞分裂の際に形成される分裂装置(星状体・紡錘体・染色体をまとめてこう呼ぶ。星状体・紡錘体は中心体・微小管複合体そのものをその形態からこう呼んだ)の主体は、この微小管である。
微小管は主に、
αチューブリンとβチューブリンが結合したヘテロ二量体(ヘテロダイマー)を基本単位として構成される。α, βチューブリンからなる
ヘテロ二量体が繊維状につながったものをプロトフィラメントと呼び、これが螺旋の形で11-16本程度集まって管状の構造を取ったものが微小管である。細胞中に見いだされる微小管の主なものは13本のプロトフィラメントからなり、直径が約25nmである。また、鞭毛・繊毛にはダブレット、トリプレットと呼ばれる2本または3本の微小管が融合した構造も見いだされる。
細胞中の微小管の表面には微小管結合タンパク質 (MAPs) と呼ばれるタンパク質が結合している。これらの結合タンパク質の種類は神経細胞、鞭毛、繊毛、紡錘体など、組織や微小管の機能によって異なっており、微小管の機能を調節していると考えられている。チューブリンとこの微小管結合タンパク質の複合体を広義には微小管と呼ぶ。
分裂装置の主体である微小管の不全をもたらすことは、
細胞分裂を阻害することから分裂毒と呼ばれている。
コルヒチンやビンカアルカロイド系の抗がん剤(ビンクリスチンなど)は微小管の伸長を阻害し、タキサン系の抗がん剤(ドセタキセル、パクリタキセル)は逆に解離を阻害し、微小管を極度に安定化する。
ヒストン
真核生物のクロマチン(染色体)を構成するタンパク質の一群。非常に長い分子である DNA を核内に収納する役割を担う。
ヒストンはDNAに結合するタンパク質の大部分を占め、ヒストンとDNAの分子量比はほぼ1:1で、ヒストンとDNAの相互作用は遺伝子発現の最初の段階である転写に大きな影響を及ぼします。
ヒストンは大きく5種類に(H1, H2A, H2B, H3, H4)にわけられる。
このうち、H2A、H2B、H3、H4の4種は、コアヒストンと呼ばれ、それぞれ二分子が集まり、ヒストン八量体(ヒストンオクタマー)を形成する。
一つのヒストンオクタマーは、約 146 bp の DNA を左巻きに約1.65回巻き付ける。
この構造はヌクレオソームと呼ばれ、クロマチン構造の最小単位である。
ヒストンでは、N末端のリシン残基がアセチル化、脱アセチル化され、これが遺伝子発現の制御に関わっている。
ヒストンが多数アセチル化されている染色体領域は、遺伝子の転写が活発に行われており、ヒストンのアセチル化は遺伝子の発現を活性化させ、脱アセチル化は遺伝子の発現を抑制していると考えられている。
これらの反応はヒストンアセチルトランスフェラーゼ(HAt)、ヒストン脱アセチル化酵素=ヒストンデアセチラーゼ(HDAc)によって触媒される。
ヒストン脱アセチル化酵素(HDAc)とはクロマチン構造中のヒストンと呼ばれるデオキシリボ核酸(DNA)が巻きついているタンパク質の脱アセチル化を行う酵素であり、遺伝子の転写制御において重要な役割を果たしている。
HDACファミリーの分子は現在HDAC1-11まで同定されている。
ヒストンアセチル化の他にも
リン酸化や
メチル化による制御を受ける。
ヒストン脱アセチル化酵素(HDAC)は
細胞内情報伝達(Notchシグナリング等)や
細胞周期の制御にも関与している。
特に近年、
HDACは癌治療の標的分子として注目されている。
微生物
人の肉眼では構造が判別できないような微小な生物を指す言葉である。
体躯が微小であるとの理由のみで区分されるため、分類上は、極めて広範囲にわたる分類群を含む。
むしろ、微生物でないのは大型多細胞生物だけであり、植物界、それに動物界とストラメノパイル(鞭毛に中空の小毛を持つ真核生物の一群)の中にしか存在しないとも言える。
微生物は真正細菌、古細菌のみならず、真核生物(藻類、原生生物、菌類、粘菌)や、ワムシのようなごく小型の動物も含まれる。
なお、菌類などでは肉眼的なコロニーを作るものであっても、カビのように、その体の構成単位が顕微鏡的大きさであるものは、微生物として扱われる。
微生物には非常に様々なものが含まれ、その生活も様々である。
植物的に光合成しているもの、菌類的に有機物を分解するもの、動物的に他の微生物を捕食するもの、あるいは大型動物と寄生や共生の関係にあるもの、また微生物間での寄生や共生も知られる。
それらは我々の目に触れないところで行われるため、詳細は未だ判明しない部分が多い。しかし全体としてこれらの生物の活動は肉眼的に変化をもたらすこともある。
たとえば食物を放置しておくと、カビや細菌類が繁殖し、その結果として食物は変質して食べられなくなる。
この変化を腐敗といい、微生物が原因といわれるが、そこに出現する微生物の種は多様で、それぞれに生活も異なるから、どれが原因で何が起きたのか、あるいはそこにいるすべての微生物にその責任があるかははっきりしない。
我々はそれが区別できないためにそれらをすべてまとめて微生物の働きで腐敗が起きたと考える。
しかし、これは有機物を食べて体内で分解して無機物とし、残りを排出するという点で我々の生命活動とさほど変わらないものである。
自然界の死んだ有機物塊は彼らの働きによって次第に無機物に変わってゆくが、この過程を分解といい、自然における浄化力の源と考える。
実際には腐敗もこの過程のひとつにすぎない。
そこで自然界における微生物の働きを分解者と呼ぶ。実際にはその中での生物間の諸関係があることは重要であるが、それらをブラックボックスに閉じこめての命名といえる。
なお、腐敗の具合によっては特殊な成分を生じて食べられたり、何か利用可能なものができたりする例もあり、その場合には腐敗といわずに醗酵といっている。
大型生物の体の表面や、体内に生活するものも多く知られる。それらの多くはその生物と何らかの関係を持って生活している。
一部のものは、繁殖するとその生物の生活に悪影響を与えそのようなものは病原体と言われる。
微生物の研究は病原体研究を元に発展したような面があり、そのため菌は危険なものとの認識もあるが、大型動物に寄生し、しかもその生態防御システムをかいくぐって侵入繁殖し、しかも有害な働きをなす、というのは極めて特別な能力を持った生物にのみ可能なことである。
ただし表皮が傷ついた場合、体表の防御を通らずに体内に微生物が侵入するので、微生物が繁殖することは簡単である。
いわゆる膿はその状態で体内の生体防御が働いている状況で生まれるものである。
実際には大型生物は微生物にまみれて生活し、普段は気がつかないままに互いに影響を与えあって生活している。
腸内には
腸内細菌、あるいは腸内微生物といわれる独特の生物群があり、それらは消化や健康とも深い関連を持っている。
なお、これらの微生物には大型動物に利益をもたらす面も害をなす面もあるが、どちらが大きいのかについては不明である。
出産時から人工的な管理下におき、一切の微生物を排除した動物(無菌マウスなど)を作ることが可能であるが、その場合、寿命が普通個体よりも長いので、総計すれば害の方が大きい、との説もある。
ビタミンD
ビタミンD (vitamin D) は、ビタミンの一種であり、脂溶性ビタミンに分類される。
ビタミンDはさらにビタミンD2(エルゴカルシフェロール、Ergocalciferol)とビタミンD3(コレカルシフェロール、Cholecalciferol)に分けられる。
ビタミンD2は植物に、ビタミンD3は動物に多く含まれ、
ヒトではビタミンD3が重要な働きを果たしている。
機能
ビタミンDは、活性型ビタミンD(カルシトリオールまたは、1,25-ジヒドロキシコレカルシフェロール)として、次の方法により血中のカルシウム(Ca2+)濃度を高める作用がある。
1.腸からカルシウムの吸収を高め血中濃度を高める。
2.腎臓の働きによりカルシウムの血中から尿への移動を抑制する。
3.骨から血中へカルシウムの放出を高める。
また、
ビタミンDは免疫反応などへの関与も示唆されている。
作用機構および機能の多様性から、ビタミンAとともにホルモンに分類されることがある。
ビタミンとは人体で合成できない微量栄養素という意味である。
その観点からはビタミンDはコレステロールから人体内で合成ができるためビタミンではないという意見もある。
しかし、消化管からのビタミンDの吸収が低下すると容易にビタミンD欠乏症になることから外因性のビタミンDは不可欠である。
皮膚での生成
コレカルシフェロールは、皮膚で7-デヒドロコレステロールから光化学的に生成される。7-デヒドロコレステロールは、ヒトを含むほとんどの脊椎動物の皮膚中で大量に生成される。
ビタミンDの生成に効果のある波長300nm付近の紫外線(UV-B線)はドルノ線と呼ばれる。
ヒトにおいては、午前10時から午後3時の日光で、少なくとも週に2回、5分から30分の間、日焼け止めクリームなしで、顔、手足、背中への日光浴で、十分な量のビタミンDが体内で生合成される。
生成メカニズム(ビタミンD3)
コレステロールが代謝を受けてプロビタミンD3(7-デヒドロコレステロール)となったあと、皮膚上で紫外線を受けてステロイド核のB環が開き、プレビタミンD3((6Z)-タカルシオール)となる。
プレビタミンD3は、自然発生的にビタミンD3(コレカルシフェロール)へ異性化する。
プレビタミンD3からのビタミンD3(コレカルシフェロール)への転移は、室温では12日間で完了する。
皮膚で産生されたものであれ経口摂取されたものであれ、ビタミンD3(コレカルシフェロール)は、肝臓でC25の位置でヒドロキシ化の代謝を受け 25-ヒドロキシコレカルシフェロール(別名25(OH)D3 、カルシジオール)へと変化し肝細胞に貯えられ、必要なときにα-グロブリンと結合しリンパ液中に放出される。
なお、Cの番号はステロイドやコレステロールの構造と炭素の番号に由来する。
カルシジオールは、腎臓の尿細管に移送され、2つの種類のビタミンDの型に変化する。一つは活性型ビタミンD(1,25-ジヒドロキシビタミンD3 、カルシトリオール)となる。
ヒドロキシ化されたC1は下側リング右側に位置する。
ホルモン作用を有する活性型ビタミンD(カルシトリオール)は、副甲状腺ホルモンに加えて低カルシウム、低リン酸状態により活性化したカルシジオール-1-モノオキシゲナーゼ(1α-ヒドロキシ酵素)によって生成される。
1α-ヒドロキシ酵素が不活性な場合には、別の酵素がカルシジオールのC-24をヒドロキシ化して、もう一つの非活性型ビタミンD(24,25-ジヒドロキシビタミンD3)を生成する。
この反応によりカルシジオールは生化学的な作用から不活性化される。
また、不要となったカルシトリオールは、カルシトリオール24-ヒドロキシラーゼの触媒作用によってカルシトロン酸が生成される。
この物質は、水に溶け、尿中に排泄される。
作用のメカニズム
カルシトリオールは、循環器系に放出される。
リンパ液中の輸送物質であるビタミンD結合タンパク質(VDBP)と結びついてカルシトリオールは、様々な対象臓器に運ばれる。
カルシトリオールは、対象細胞の細胞核内に主に所在するビタミンD受容体(VDR)と結びついてその生体効果を発現する。
カルシトリオールとビタミンD受容体(VDR)との結びつきは、
腸内でカルシウム吸収に関わっているようにビタミンD受容体が(TRPV6(腸内でのカルシウム吸収の第一段階をつかさどる膜カルシウムチャンネル)やカルビンディン(腸及び腎臓でのビタミンD依存型のカルシウム結合タンパク質として初めて発見されたカルシウム結合タンパク質)のような)
輸送タンパク質の遺伝子発現を調節する転写因子として作用させることである。
ビタミンD受容体は、ステロイド/甲状腺ホルモンの核内受容体の一群に属している。
脳、心臓、皮膚、生殖腺、前立腺及び乳房を含むほとんどの臓器の細胞で作用している。
腸、骨、腎臓及び副甲状腺の細胞でのビタミンD受容体の活性化は、(甲状腺ホルモン及びカルシトニンの補助により)
血中のカルシウム及びリン酸の濃度の維持及び骨密度の維持を司っている。
ビタミンD受容体は、
細胞の増殖と分化に関わっていることが知られている。
ビタミンDは
免疫システムにも影響を及ぼしているし、ビタミンD受容体は、単核白血球、活性化T細胞及びB細胞を含むいくつかの白血球で作用している。
ビタミンD受容体以外の様々なメカニズムの作用が知られている。
これらの作用のうち重要なものの一つとして形態形成に関わるホルモンなどシグナル伝達経路によるシグナル伝達の天然の酵素阻害剤としての作用がある。
ビタミンDが不足すると
高血圧、結核、
癌、歯周病、多発性硬化症、冬季うつ病、末梢動脈疾患、1型糖尿病を含む自己免疫疾患などの疾病への罹患率上昇と関連している可能性が指摘されている。
パーキンソン病と低いビタミンDレベルとの間には関連があるが、パーキンソン病が低いビタミンDレベルを引き起こしているのか、低いビタミンDレベルがパーキンソン病を引き起こしているのかはわかっていない。
過剰症
高カルシウム血症、肝機能障害、腎臓障害、多飲・多尿、尿路結石、尿毒症、高血圧、易刺激性(不機嫌)、腹痛、発熱、発疹、かゆみ、吐き気または嘔吐、食欲不振、便秘、虚弱、疲労感、睡眠障害、歩行困難、体重減少、貧血、脱毛、けいれん、昏睡など。
カルシジオール (25-hydroxy-vitamin D) として人の体内に貯蔵されているビタミンDの半減期は20日から29日である。
通常、活性型ビタミンDの生合成は厳密に調節されており、過剰のビタミンDを摂取した場合にのみ毒性が認められる。
食品やビタミンD製剤の濃縮レベルは、成人にて毒性を認める量と比較するとはるかに低い量である。
疾病との関連
ビタミンD受容体結合体は、ナチュラルキラー細胞の活動とマクロファージの食作用を活発化させることが示されている。
活性ビタミンDホルモンは、バクテリア、ウイルス、菌類によって活性化されるマクロファージで産生される抗菌性ペプチドのキャセリシジン(英)を増加させる。
ビタミンDと高緯度で比較的発症例の多い免疫異常が原因の可能性がある多発性硬化症との関係においては、ビタミンDの免疫反応の抑制特性と、多発性硬化症を遺伝的に発症しやすい個人の自己タンパク質と異種タンパク質の相違の識別に必要な組織適合遺伝子(HLA-DRB1*1501(全身性エリテマトーデスの古典的遺伝子マーカーとして知られている))のプロモーターにビタミンD応答配列(VDRE)があるため遺伝子の発現にビタミンDが必要とされること、が関係すると示唆されている。
妊娠中のビタミンDサプリメントの服用が子供の成長ののち多発性硬化症を発症する可能性が低まるかどうかは、まだ分かっていないが、ビタミンD の生体防御機構がアレルギー性疾患の蔓延を引き起こしているのではないかとも疑られており、幼児期のビタミンDサプリメントの摂取と成長後のアトピーとアレルギー性鼻炎のリスクの増加との関係が見出されている。
しかし、妊娠期のビタミンD不足と子供のアレルギー発症が相関し、また臍帯血のビタミンD濃度と子供のアレルギーにはU字型の相関が見られるという研究もあり、エピジェネティックな仕組みが関与している可能性も指摘されている。
ベテランのビタミンD研究者 のヘクター・デルカは、ビタミンDが多発性硬化症に影響を及ぼすかどうかには疑問を抱いている。
インフルエンザ
ビタミンD生合成の減少は、冬におけるインフルエンザの高い罹患率を説明できる可能性があるが、冬にインフルエンザが流行するのはビタミンD生合成の減少以外の仮説(乾燥、低温、日照殺菌低下等)を立てることができるとしている。
2010年3月にアメリカ臨床栄養ジャーナルに発表された無作為抽出、二重盲検法、プラセボ(偽薬)対照試験の結果では、冬季に毎日1,200IUのビタミンD3を摂取した生徒群は、プラセボを摂取した生徒群に比較して、42%も季節性インフルエンザに罹患する率が低かったとしている。
癌予防との関連
ビタミンDの分子的特質は、癌の防止に関して癌の増殖の主たる細胞メカニズムに幅広い範囲で潜在的に関わっていると考えられている。
これらの効果は、癌細胞でのビタミンD受容体を媒介している可能性がある。ビタミンD受容体(VDR)遺伝子の多型現象は、乳癌のリスクの増加に関わっている。
女性におけるビタミンD受容体遺伝子の変異は、乳癌のリスクを増加させている。
米国では日照の少ない緯度の高い地域での大腸癌、乳癌、卵巣癌、多発性硬化症の相対的な多発が指摘されている。
13カ国の400万人以上の癌患者のデータを用いた2006年の研究では、日照の少ない国での特定の癌のリスクの顕著な増加が示され、その他の関連研究でもビタミンD濃度と癌の間の相関関係が示されている。
この著者は、毎日 1,000IU(25μg)のビタミンDの追加摂取はヒトの
大腸癌のリスクを50%減少させ、乳癌と卵巣癌のリスクを30%減少させると示唆している。
血清中の低濃度のビタミンDは、乳癌関連疾患の進行と骨転移に相関があるとしている。
しかしながら、住民のビタミンD濃度は、晒されている日照に依存していないとする報告がある。
さらには、高緯度地域で一般的な癌の発生率と死亡率には遺伝的要素が関わっているとする報告もある。
2006年の研究では、2つの長期健康調査による12万人以上の調査対象者でビタミンDの米国摂取基準(400 IU/日)の摂取により、
膵臓癌のリスクを43%減少させたとする。
しかしながら、男性喫煙者では、25-ヒドロキシビタミンDの血中濃度が最大の群と最小の群(5分割群)を比較して3倍の膵臓癌のリスクがあるとした。
2007年6月に発表された無作為に抽出された1200人の女性を対象とした研究では、ビタミンDの摂取(1,100 IU/日)は、4年間の臨床試験で、癌の発生率を60%減少させ、最初の1年後では77%減少させたとしている(なお、ビタミンDの投与前に起因していたと思われる癌は除かれている)。
ビタミンDの摂取の別の研究で発見された長期間にわたる癌全般の増加を考慮に入れていないことを含め、幾つかの点でこの研究は批判されているにもかかわらず、カナダ癌学会(全国規模の有志による組織)は、成人は1日1,000IU(政府の発表した必要量の5倍)を摂取すべきと2007年に勧告している。
アメリカ国立癌研究所の研究は、第3回米国全国健康栄養調査のデータにおける17歳以上の16,818人の対象群の血中で循環しているビタミンD濃度と癌死亡率との関係を分析した。
その結果、25-ヒドロキシビタミンD と全癌死亡率との関連は見出されなかった。
他の研究とは異なりこの研究は、実際の血液検査からビタミンDの総量を測定しようとして、むしろ潜在的に不正確な予測モデルからビタミンD濃度を推論しようとしていたのではないかとも指摘されている。
アメリカ国立癌研究所は、ビタミンDの摂取が大腸癌及びその他の癌の予防効果について限定されているか証拠が不十分なので、大腸癌及びその他の癌の予防のためにビタミンDサプリメントの摂取を勧奨はしないとした。
消化液の胆汁酸が腸内で二次胆汁酸に変化すると、その一部が発癌を促進する。
この二次胆汁酸にカルシウムが結合することで無毒化されて便中に排泄されるという説がある。
また、
カルシウムはビタミンDと一緒に腸粘膜細胞の分化などを正常化する作用も実験的に示されているとしている。
また、
カルシウムとビタミンDの両方を多く摂取するグループで大腸癌のリスクが低下するとの報告がある。
ヒト常在細菌叢
ヒト常在細菌群とは、人と共生している菌を、「常在菌」とよび、常在菌は「細菌」と「真菌」(カビ)に分けられ、細菌のほうが圧倒的に多い。
健康な人が常に持っている菌が見つかれば、たとえそれが10人に1人でしか見つからない菌だとしても、常在菌と呼ばれる。
菌は、みずから栄養分をつくりだすことができないので、まわりの環境から栄養をもらって生きている。
食べ物のカスや未消化の食べ物が数十時間も滞在する大腸は、栄養が豊富にあり、体の中で常在菌が最も多い場所だ。
常在菌がいない場所は、 健康な人の場合、骨髄や筋肉などの組織、肺や脳などの臓器 、体液(血液、分泌前の唾液)には常在菌はいないとされている。
従来、微生物の数や種類を調査する際には、「培養法」という技術が用いられてきました。「培養」というのは、微生物が生きていくために必要な栄養素を人工的に調整し、そこに微生物を生育させて「目に見える形」で育てる方法です。
みなさんも、中学校や高校の理科の授業でシャーレを使ったことがあるのではないでしょうか。
「培養法」は、シャーレに微生物の栄養源を入れ、そこに目的の微生物を生育させる手法です。
でも、実はこの手法では、地球上に存在する微生物の内、なんと1%程度しか培養できていないことが分かってきました。
それは、その他99%の微生物を人工的に育てるための栄養に、何が必要なのかが分かっていないからです。
「皮膚常在菌」も、腸内にいる「腸内細菌」も、未だに培養できる微生物は、わずかしかいないと考えられています。
そこで考え出されたのが「16S rRNA遺伝子解析」です。
この技術をきちんと説明するとかなり難しいので、簡単に説明します。
培養ができない微生物でも、「RNA」は研究手法として摂取することができます。
「RNA」とは「DNA」から作られる遺伝子関連成分です。
この「RNA」はA(アデニン)、U(ウラシル)、G(グアニン)、C(シトシン)という4種類の塩基が並んでできています。
微生物の体の中には、タンパク質を作るための「リボソーム」という場所があり、この「リボソーム」を作るための「RNA」が「16SrRNA(16SリボソーマルRNA)」という名前なのです。
この「16SrRNA」は微生物の種類ごとにAUGCの並び方が決まっていて、この並び方を解析することで、サンプルに含まれている微生物の種類やおよその数が分かるようになったのです。
「培養法」を使わずに、全ての微生物の種類と数が分かる「16SrRNA遺伝子解析」の技術により、これまでに見えなかったミクロの世界が見えてきました。
ビフィズス菌
グラム陽性の偏性嫌気性桿菌の一種で、放線菌綱Bifidobacteriales目Bifidobacterium属に属する細菌の総称。
人間の腸管にはB. bifidum、B. breve、B. infantis (B. longum subsp. infantis に再分類)、B. longum、B. adolescentisの5種が棲息する。特に母乳栄養児の糞便に多く存在する。
糖を分解して乳酸、酢酸を作るヘテロ乳酸菌の仲間でもある。
善玉菌として腸内の環境を整えるほか、花粉症などアレルギー症状の緩和にも貢献していることが分かってきた。
非リボソームペプチド合成酵素
微生物や細菌の二次代謝産物の中で、アミノ酸が多数結合している構造のものを指す。
NRP、もしくはNRPsと略記される。
裸鰓類のような高等生物もNRPを作り出していることが知られているが、それも生体内部に住み着いた微生物によるものではないかと考えられている。
ペプチド結合を多数持つにもかかわらずリボソームを経由せずに合成されるため、非リボソームペプチドと呼ばれている。
リボソームで合成されるポリペプチドとは異なり、非リボソームペプチド合成酵素によりアミノ酸から合成される。
この酵素はNRPSと略記されるため、NRPsとの混同には注意が必要である。
NRPSはモジュール式の分子組み立て工場のモデルで説明されることが多い。
mRNAを設計図としてペプチド鎖を合成するリボソームとは異なり、NRPSには設計図がなく各NRPSにより合成できる分子もあらかじめ決まっている。
非リボソームペプチドはリボソームペプチドより非常に多様な分子構造を持っており、様々なNRPSにより合成される。
NRPは環状構造もしくは枝状構造を取ることが多く、コドンにコードされていないアミノ酸(D-アミノ酸や、N-メチル化、N-ホルミル化、グリコシル化、アシル化、ハロゲン化、ヒドロキシル化などの修飾を受けたアミノ酸)を含むことも多い。同じ配列のペプチドが二量体、三量体となりNRPを形成することも多い。
ペプチド鎖が環化されることもあり、オキサゾリンやチアゾリンといった酸化還元可能な分子も合成される。
また時には脱水素化も行われ、セリンからデヒドロアラニンが合成される。これらはほんの一例であり、他にもNRP合成酵素により多様な反応・合成が行われている。
非リボソームペプチドは非常に多様性を持った構造の分子であり、自然界にも生理学的活性や薬理学的特性を持つ分子として広く存在している。毒性を持つものが多く、親鉄性を持ち、着色していることが多い。
このうち一部は抗生物質、細胞増殖抑制剤、免疫抑制剤として利用されている。
ビルビン酸キナーゼM2(pyruvate kinase M2 (PKM2))
ピルビン酸キナーゼM2(PKM2)は、グルコースをエネルギーに変換する代謝過程にも関係する遺伝子のひとつであり、代謝過程の第一段階を触媒し、
がん細胞だけに存在しています。
ピルビン酸キナーゼは解糖系の律速酵素で、正常では4量体として存在する。
がん細胞では腫瘍特異的な2量体のM2というアイソフォーム(PK-M2)が多く発現している。
2量体のピルビン酸キナーゼ-M2はホスホエノールピルビン酸からピルビン酸の変換ができない。
解糖系の途中におけるグルコースの代謝産物は、核酸や脂肪酸やアミノ酸の材料になる。
細胞分裂によって増殖するがん細胞は、エネルギー産生と同時に細胞を構成する核酸や脂肪酸やアミノ酸の合成を増やす必要がある。
腫瘍特異的に発現するピルビン酸キナーゼ-M2はがん細胞におけるエネルギー産生と物質合成のバランスを調節している。
解糖系の酵素であるPKM2はワーバーグ効果に関与していることが以前から示されていた。Hypoxia-inducible factor 1
(HIF-1)は、PKM2遺伝子の発現を調節しており、
PKM2がHIF-1の転写活性化因子としての機能も有している。
腫瘍細胞ではPKM2を発現させることによって、解糖系を活性化させている。
PKM2の305番目のリシンのアセチル化は細胞内のグルコース濃度が高いと活性化される。このアセチル化によって、PKM2の酵素活性が低下し、リソソーム依存的なタンパク質分解が生じる。
一方このリシンをグルタミンに置換するとアセチル化が模倣され、置換によって解糖系の中間体の蓄積、腫瘍細胞の増殖が引き起こされる。
PKM2の活性はリン酸化だけでなく、アセチル化によっても調節を受けていることが分かった。
腫瘍性ピルビン酸キナーゼ-M2の阻害作用
紫根抽出液、紫根牡蛎湯
ファイトケミカル
フィブリノゲン
血液凝固因子。肝臓で作られるたんぱく質で、糊状になって血液を固まらせて出血を止める。
フィブロネクチン
高分子(約440kDa)の糖タンパク質であり細胞外マトリックスのひとつ。
細胞膜上の受容体タンパク質であるインテグリンと結合する。
またコラーゲン、フィブリン、ヘパラン硫酸プロテオグリカン(たとえばシンデカン)などの細胞外マトリックスとも結合する。
細胞外マトリックスと細胞を接着させるタンパク質のひとつ。
発生の過程で重要なはたらきをする。
フィブロネクチンには、たとえば細胞接着、細胞の成長、遊走、分化といった脊椎動物の正常な生命機能を支える非常に多くの機能がある。
細胞性フィブロネクチンは細胞外マトリックスとして集積して不溶性の網の目を構築し、生体の組織や器官を区画し支持している。
フィブロネクチンは創傷治癒の過程において、非常に重要な役割を果たしている。
血漿フィブロネクチンはフィブリンとともに傷害部位に沈着し、凝血塊を形成して出血を止め、その下にある組織を保護する。
傷害組織の修復が始まると、線維芽細胞とマクロファージは傷害された区域の再構成(リモデリング)のために、応急的に作られた凝血塊のタンパク質を分解してより周囲の正常な組織に似た細胞外マトリックスで置き換える。
線維芽細胞は種々のタンパク分解酵素を分泌するが、そのうちの
マトリックスメタロプロテアーゼ(MMP)は血漿フィブロネクチンを分解し、さらに線維芽細胞によって分泌された細胞性フィブロネクチンが不溶性の細胞外マトリックスに集積する。
MMPによって分解されたフィブロネクチンの断片は、創傷治癒の重要な過程である創(きず)収縮(しゅうしゅく)を促進することが示唆されている。
フィブロネクチンの断片化によってα4β1インテグリン結合部位である可変領域が暴露される。
この断片化フィブロネクチンがα4β1インテグリン発現細胞の結合を促進し、それらの細胞どうしの接着や周辺の細胞外マトリックスの強制的な収縮を可能にすると考えられる。
フィブロネクチンは胚発生にとっても必要であり、フィブロネクチン遺伝子を不活化させた胚は初期の段階で致死性となる。
フィブロネクチンは胚発生の時期においても細胞接着と移動の誘導に重要な働きをする。哺乳類の発生では、フィブロネクチンが欠損すると中胚葉、神経管および血管の発達に欠陥が起きる。
フィブロネクチンは正常なヒトの唾液中にも存在し、口腔や咽頭で病原細菌が増殖するのを防いでいる。
細胞外マトリックスの集積:
細胞性フィブロネクチンは細胞の関与する複雑な過程を経て不溶性の線維性細胞外マトリックスとして集積する(フィブロネクチンアセンブリー)。
この集積は可溶性のフィブロネクチンダイマーが分泌されると同時に開始する。
この二量体は細胞表面のα5β1インテグリンと結合し、インテグリンの細胞表面における密集を促進する。
インテグリンに結合したフィブロネクチンの局所的な濃度が高くなると、このフィブロネクチン分子どうしの相互作用が起きやすくなる。こうして短いフィブロネクチン原線維が隣接細胞間で形成されはじめる。
マトリックスへの集積が進むにつれて、可溶性の原線維はより大きな不溶性原線維へと変化し、
細胞外マトリックスを形作る。
細胞に結合したフィブロネクチン分子の折りたたまれているフィブロネクチン結合ドメインが暴露されると可溶性から不溶性原線維への移行が進む。
インテグリンのフィブロネクチン受容体に結合した部位を引っ張ることで、細胞はフィブロネクチンを折りたたまれた形から引き伸ばすと考えられる。
この力でリガンドであるフィブロネクチンが部分的に折りたたみを展開され、(折りたたみによって)隠れていたフィブロネクチン結合部位が現れて周囲にある他のフィブロネクチン分子との結合を可能にするのである。
このフィブロネクチン分子どうしの相互作用によって、細胞に結合した可溶性フィブロネクチン原線維は連鎖し安定化して不溶性の細胞外マトリックスとなる。
がん(癌)化における役割:
腫瘍や腫瘍由来の細胞系(生体外で培養された細胞)における形態学上の変異の一部については、
フィブロネクチン発現の減少や分解の進行またはα5β1インテグリンなどのフィブロネクチン受容体の発現減少あるいはその両方が原因と考えられている。
フィブロネクチンはがん化に関係している。
肺がん特に非小細胞がん(悪性度の高い小細胞がんを除いた
扁平上皮がん、腺がん、大細胞がんなど)ではフィブロネクチンの発現が増加している。肺がん細胞のフィブロネクチンへの接着によって発がん性は促進され、また
がん細胞にアポトーシスを起こさせるタイプの抗がん剤への抵抗性を生じさせる。
また性ホルモンを刺激してアンドロゲンレセプターとの相互作用によりサイクリンDや細胞周期の制御にかかわる他の遺伝子の発現をコントロールすることが示唆されている。
以上のことから
フィブロネクチンは肺がんの成長や治療抵抗性を促進していることが示唆され、それゆえ新たな抗がん剤開発におけるこれまでとは異なる標的分子となるかもしれない。
フィルミクテス門
(Firmicutes、ファーミキューテス、グラム陽性細菌門)
低GC含量(全核酸塩基中のG+Cの割合が低い)とグラム陽性に特徴付けられる真正細菌(バクテリア)の門である。
グラム陽性低GC含量細菌とも呼ばれる。
200近くの属を含み、真正細菌の中ではプロテオバクテリア門に次ぐ多様性を持つ。
腸内細菌や皮膚常在菌、病原菌あるいはヨーグルトなどの発酵食品を通じて人間にも比較的なじみの深いグループである。
フェブリン塊
フェブリン:たんぱく質の糸で、凝血塊を形成するため血小板の栓の周りを編み込みます。
その塊をフェブリン塊と言います。
フェリチン(ferritin)
血中フェリチンは鉄貯蔵たんぱくであり、悪性腫瘍や炎症性疾患で非特異的に上昇します。
このため、他の
腫瘍マーカーと組み合わせることで白血病、膵癌、肝癌の診断に用いられます。
複合脂質
分子中にリン酸や糖などを含む脂質を複合脂質という。
両親媒性(水に馴染む「親水基」と油に馴染む「親油基」(疎水基)の二つの性質)を持つものが多く、細胞膜の脂質二重層の主要な構成要素であるほか、
体内での情報伝達などに関わる。
複合脂質は、部分構造としてリン酸エステルを持つ
リン脂質と、糖が結合した糖脂質に大別される。
また、複合脂質の骨格となる分子は一般的にグリセリンあるいはスフィンゴシンのみであるため、これらを基準として
グリセロ脂質と
スフィンゴ脂質に分類することもある。
脂質とタンパク質が複合したリポタンパク質をここに含めることもある。
プラスミノーゲンアクチベーター
セリンプロテアーゼの1種で、プラスミノーゲン活性化因子ともいう。
プラスミノーゲンを活性化してプラスミンにし、血液凝固で生成したフィブリンを溶解する反応を触媒するプロテアーセで、組織型PA(t-PA)とウロキナーゼ型がある。
血管内線溶には前者が重要であり、血管新生,炎症,癌の転移等に関わる組織線溶には
後者が関与する。
腫瘍マーカーとしての働き。
血漿中ウロキナーゼタイプ プラスミノーゲンアクチベーター濃度の上昇は肝細胞癌の存在ではなく肝機能の悪化と関連する。
プロスタグランジンE2(PGE2)
癌組織においては、炎症性サイトカインや、活性酸素や一酸化窒素などのフリーラジカルによって転写因子のNF-kBが活性化され、その結果シクロオキシゲナーゼ-2 (COX-2)の発現量が増えます。
COX-2により産生されるプロスタグランジンE2は、癌細胞の増殖を促進するだけでなく、癌細胞を攻撃する免疫細胞の働きを弱めたり、癌細胞に栄養を供給する腫瘍血管の新生を誘導することによって、癌組織の成長促進に関与していることがわかっています。
癌細胞におけるCOX-2の発現は、転移や抗癌剤抵抗性と関連していることも報告されています。
COX-2(シクロオキシゲナーゼ-2)
炎症時に過剰に産生され、慢性的に炎症を生じさせます。
●死んだ細胞より放出されるプロスタグランジンE2は炎症を抑え、癌の増殖を促します。
細胞が死を迎える際には核酸やタンパク質が放出され、炎症反応を引き起こすことが知られています。
これらの分子は
ダメージ関連分子パターン(damage associated molecular patterns;DAMPs)と呼ばれ、炎症・免疫系を活性化し、自己免疫疾患や動脈硬化、癌、神経変性疾患など、炎症の関わる様々な病態に関わることが分かってきています。
したがってDAMPsはさまざまな疾患に対する治療標的として注目を浴びていますが、このようなDAMPsの中に炎症・免疫反応を抑える分子が存在するかどうかは知られていませんでした。
東京大学大学院医学系研究科の半谷匠大学院生と同生産技術研究所の柳井秀元特任准教授らの研究グループは細胞が死ぬと、プロスタグランジンE2が放出され炎症・免疫系を抑制することを見いだしました。
死んだ細胞から放出されるPGE2の働き
死んだ細胞が放出するプロスタグランジンE2(PGE2)は抑制性のDAMPとして働く。
免疫・炎症系は抑制性のDAMPと炎症反応を引き起こすDAMPとの相互作用によって調節される。
癌細胞においてPGE2の産生を抑制すると、抗腫瘍免疫応答が増強され、癌細胞の増殖が抑えられることもわかりました。
日本冬虫夏草 ツクツクホウシタケや落花生種皮抽出物(PAQ)には、プロスタグランジンE2の発生を抑制します。
プロテアーゼ(ペプチド結合加水分解酵素)
消化酵素(小腸上皮細胞から分泌)、タンパク質分解酵素、タンパク質を活性化、血液を凝固、細胞を動かしたり、神経細胞の突起を伸ばしたり、引っ込めたり、いろいろな細胞の機能にいろいろなプロテアーゼが関わっています。
プロテアーゼとは、タンパク質を形作っている結合(ペプチド結合)を切断する酵素です。 切断される際にプロテアーゼはタンパク質を抱え込み、その活性部位で切断いたします。
プロテアーゼの分類
分解の位置による分類
・エキソペプチダーゼ、タンパク質、ペプチド鎖の配列末端から(およそ1~2アミノ酸残基ずつ)切り取るタイプのもの。
・エンドペプチダーゼ、タンパク質、ペプチド鎖の配列中央を切断するタイプのもの。
基質による分類
・プロテイナーゼ(Proteinase)・タンパク質を分解するもの。
・(狭義の)ペプチダーゼ(Peptidase)・より分子量の小さな合成ペプチドなどを分解するもの。
触媒機構による分類
・セリンプロテアーゼ、キモトリプシン(chymotrypsin)、スブチリシン(subtilisin)など。
・アスパラギン酸プロテアーゼ(酸性プロテアーゼ)(aspartic protease)、ペプシン、カテプシンD(cathepsin D)、HIVプロテアーゼなど。
・金属プロテアーゼ(メタロプロテアーゼ)・サーモリシン(thermolysin)など。
・システインプロテアーゼ(cysteine protease)、パパイン、カスパーゼなど。
・この他にもプロテアソーム(proteasome)で知られるようになったN-末端スレオニンプロテアーゼ
(N-terminal threonine protease)やグルタミン酸プロテアーゼ(glutamic protease)などが新たに見つかっている。
プロテオグリカン
動物成分の多糖(グリコサミノグリカン:glycosaminoglycan)の研究中に見つけ出された成分である。
グリコサミノグリカンとしては、ムコ多糖として全身に存在するヒアルロン酸や軟骨から分離されたコンドロイチン硫酸(1889)などが有名であるが、これらのグリコサミノグリカンの構造解析を行っている中で、 グリコサミノグリカンとコアタンパク質(Core Protein)が一定の結合様式で結合した糖たんぱく質が発見された。
これらの一定の構造を持つ成分を1970年にプロテオグリカン(Proteoglycan)と命名した。
プロテオグリカンは、一定の結合様式を持った分子の総称である。
プロテオグリカンは、コアタンパク質のアミノ酸であるセリンと糖質のキシロース←ガラクトース←ガラクトース←グルクロン酸が結合しコンドロイチン硫酸などの2糖単位で連続する多糖体が結合した化合物である。
プロテオグリカンが主に存在する細胞外マトリックスは、神経系や免疫系などと共に高等多細胞動物にしか存在しない組織であり、プロテオグリカンが多細胞動物以外で認められることは無いと考えられる。
各組織のプロテオグリカンは、その組織細胞で合成される。
組織の
細胞外マトリックス成分であるヒアルロン酸は、細胞膜で合成されるが、
プロテオグリカンは、ゴルジ体内で生合成される。
細胞外に放出されたコラーゲンやヒアルロン酸、プロテオグリカンは
会合構造をとることで組織を維持する。巨大なプロテオグリカンが分子単体で存在することは難しい。
プロテオグリカンは、細胞外マトリックスや細胞表面、軟骨などに多く存在し、組織形成や伝達物質など身体組織の形成と維持のための重要な成分であると考えられている。
生体成分として多様な機能性を持つと考えられるプロテオグリカンは、もっとも重要な生体成分であり、主要な各種臓器、脳、皮膚を始めとした体全体の組織中の細胞外マトリックスや細胞表面に存在するほか、関節軟骨の主成分としても存在している。
プロテオグリカンは、組織形成や伝達物質としての役割など、組織維持修復に関係する成分である。
また、プロテオグリカンは、コラーゲンやヒアルロン酸とマトリックスを作ることで身体組織や皮膚組織を維持している。
サイズによるプロテオグリカンの分類。
大きいプロテオグリカンの例はアグリカンやバーシカン等
スモールロイシンリッチプロテオグリカンはデコリン、ビグリカン、フィブロモジュリン、ルミカン等
プロトロンビン
血漿(けっしょう)タンパク質の一つ。血液凝固の第因子で、トロンビンの前駆体。
セリンプロテアーゼ(タンパク分解酵素)の一つである。
肝臓でつくられ、トロンボプラスチンやカルシウムイオンの作用を受けて活性型のトロンビンとなる。トロンボーゲン。
分化の乱れ
私たちのからだは、多くの細胞からできていますが、からだが正しく作られて維持されるためには、細胞同士がコミュニケーションをとって、そのふるまいを調和させる事が欠かせません。
胚発生におけるコミュニケーションの乱れは奇形などの発生異常につながり、成体における
コミュニケーションの乱れは、腫瘍の形成や器官の大きさの異常などにつながります。
接触による細胞間のコミュニケーションをになう Hippo シグナル経路について。
Hippo シグナル経路は、もともと、ショウジョウバエにおいて、
がん抑制シグナル経路として同定された新しいシグナル経路であり、ヒトやマウスにおいても同様のシグナル経路が存在し、
細胞増殖を調節することにより、発がんの抑制や肝臓などの臓器の大きさの制御にかかわっていること、また、それ以外にも幹細胞性の維持、細胞の分化の制御にもかかわっていることが明らかにされてきた。
ショウジョウバエでは、
Hippo 経路はカドヘリン様の細胞間接着因子Fat によって活性化されるため、このシグナル経路は、細胞間の接着により制御されるシグナル経路ではないかと考えられているが
Hippo シグナル経路を活性化する要素は多岐にわたっており、シグナル経路の制御機構はいまだ不明な点が多い。
β酸化(脂肪酸の分解)
脂肪酸を酸化してアセチルCoAを生成する細胞内の代謝経路。
アセチルCoAはクエン酸回路に組み込まれ、細胞のエネルギー源となるATPが産生される。βは、脂肪酸のβ位(末端のカルボキシル基から2番目)の炭素が順次酸化されることからβ酸化と言われる。
β酸化によってアセチルCoA、
NADH、FADH2を生み出すことができる。
β酸化に関与している酵素はミトコンドリアのマトリックスに存在する。
そのため、細胞質の脂肪酸はミトコンドリアに移行する必要がある。
脂肪酸をミトコンドリア内に移行させるにはカルニチンが必要であり、カルニチンと脂肪酸が結合することでミトコンドリア内膜を通過することができる。
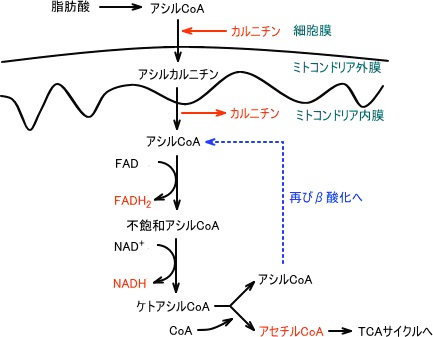
アシルCoAは一回のβ酸化によってアセチルCoA一分子を遊離する。
アセチルCoAは炭素数2の分子であるため、一回のβ酸化によって炭素数が2少ないアシルCoAとなる。
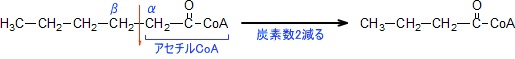
一回のβ酸化で炭素数2の分だけ減るため炭素数が偶数の脂肪酸の場合、「脂肪酸の炭素数 ÷ 2」の数だけのアセチルCoA、NADH、FADH2が生み出される。
なお、天然に存在する脂肪酸のほとんどは炭素数偶数であるが、奇数個の脂肪酸も存在する。
奇数個の脂肪酸をβ酸化する場合、最後にプロピオニルCoAを生成する。
なお、脂肪酸は「飽和・不飽和」や「炭素数偶数・奇数」に関わらずβ酸化を受ける。
NADH、FADH2:還元型フラビンアデニンジヌクレオチドは、燃料分子の酸化でのおもな電子の運び手である。
化学栄養生物は、グルコースや脂肪酸などの燃料分子の酸化によってエネルギーを得る。好気性生物では、最終的な電子の受容体はO2(酸素)である。
しかし、電子は燃料分子やその分解産物から直接O2に移されるのではなく、これらの基質は特定の担体(輸送体)に電子を移す。
この担体はピリジンヌクレオチドpyridine nucleotideかフラビンflavinのどちらかである。次にミトコンドリアの内膜の電子伝達系によって、そのポテンシャル(エネルギー価)の高い電子をO2へ移す。
これが次にATP(アデノシン三リン酸)合成へと進む。この経路は酸化的リン酸化(oxidative phosphorylation)とよばれ、好気性生物のATPのおもな供給源となっている。
多くの還元的な生合成の電子供与体はNADPH、つまり還元型のNADP(ニコチンアミドアデニンジヌクレオチドリン酸)である。
NADPHは、そのアデノシン部分の2'-ヒドロキシル基がリン酸でエステル化している点で、NADHとは異なる。
NADP(ニコチンアミドアデニンジヌクレオチドリン酸)は、解糖系のエントナー-ドウドロフ経路などで用いられている電子伝達体で、脱水素酵素の補酵素として一般的に機能している。
ヘリックスターンヘリックスタンパク質
ヘリックスターンヘリックス(Helix-turn-helix、HTH)とは、
タンパク質の主要な構造モチーフの一つで、DNAに結合する性質を持つ。
2つのαヘリックスが短いペプチド鎖で繋がった構造を持ち、遺伝子発現を制御するタンパク質に特に多く見られる。
このモチーフは、Cro、CAP、λリプレッサーに存在する20-25アミノ酸残基の共通配列として発見された。
特にDNAを認識し結合する部位は2つのヘリックスのうち1つのN末端ともう1つのC末端にある。
またCroリプレッサーを含む多くの場合は2つ目のヘリックスはDNAの認識に関わっている。
DNAへの結合は水素結合と塩基部分のファンデルワールス力によっている。
もう1つのヘリックスはDNAとタンパク質の結合を安定化させるが、その認識にはあまり関わらない。
ペルオキシソーム
ペルオキシソームはほぼ全ての真核細胞が持つ細胞小器官で、多様な物質の酸化反応を行っている。
一重の生体膜に包まれた直径0.1-2マイクロメートルの器官で、多くは球形を成す。
哺乳類の細胞では数百から数千個が一細胞内に存在する。
環境や細胞によって必要とされる機能が異なるため、数大きさ構造等様々に異なる。
発見当初はミクロ(マイクロ)ボディとも呼ばれたが、後に機能に基づいた名称が提案され現在ではそれが広く受け入れられている。
また、ミクロソームという似た名称の物があるが、ミクロソームは細胞をホモジェナイズした際に断片化された膜器官(主に小胞体)が再び閉じて形成された小胞であり、両者は異なる。
ペルオキシソームの関わる代謝経路には、
長鎖脂肪酸のベータ酸化、コレステロールや胆汁酸の合成、アミノ酸やプリンの代謝などが知られ、これらは内腔に含まれるオキシダーゼによって行われる。オキシダーゼの働きによって活性酸素の一種である過酸化水素が発生するが、これは同様に内腔に含まれるカタラーゼによって分解される。
ペルオキシソームは、リソソームやゴルジ体等の細胞小器官と異なり、小胞輸送を利用せず、細胞質から直接蛋白質を取り込み成長し、ミトコンドリアのように分裂して増殖すると考えられてきた。
しかし、構成蛋白質が小胞体を経由するという報告もあり、小胞体起源で形成される過程も存在する可能性が高まっている。
偏性嫌気性菌
絶対嫌気性菌ともいう、遊離の酸素のない状況でのみ生育できる微生物。
偏性嫌気性生物
大気レベルの濃度の酸素に暴露することで死滅する。
発酵および嫌気性呼吸を行う
ベンゾピレン
5つのベンゼン環が結合した多環芳香族炭化水素(PAHs)で、化学式C20H12で表される。常温では淡黄色の板状または針状晶で、発癌性、変異原性、催奇形性が報告されており、国際がん研究機関(IARC)ではIARC発がん性リスク一覧でグループ1(ヒトに対する発癌性が認められる)に分類している。
有機物質の燃焼の過程で、炭化水素化合物が不完全燃焼し生成される。
発生源は多岐に亘り、化石燃料や木材の燃焼、食料(動植物)の調理、その他の動植物の燃焼の過程で発生する。
燃料を燃やす鉱工業や石油精製、自動車などの輸送機器、山火事やゴミ焼却や焚き火などが主な発生源で、そのほか調理時の煙や焦げ、タバコの煙など、火のある所全般が発生源となる。
特に能動的に煙を吸う喫煙や煙を利用する燻製が憂慮されている。
ペントースリン酸経路(Pentose phosphate pathway:PPP)
解糖系のグルコース-6-リン酸から出発して、同じく解糖系のグリセルアルデヒド-3-リン酸へとつながる経路で、NADPH(還元型ニコチンアミドアデニンジヌクレオチドリン酸)や、デオキシリボース、リボースといった核酸の生合成に不可欠な糖を含む各種ヘキソース(六炭糖)の産生に関与する。
また、NADPHの供給源として脂質の生産にも関与している。
ペントースリン酸経路によって、1分子のグルコース-6-リン酸から1分子のCO2と2分子のNADPHが生成される。
肝臓、脂肪組織、精巣、副腎皮質、授乳期の乳腺においてペントースリン酸経路の活性は高い。
補体
正常血清成分で、約20種類のタンパク質から成ります。
体内に侵入した異物に補体が結合すると、マクロファージなどの食細胞に認識されやすくなります。
つまり、侵入した異物やウイルスに感染した細胞やがん細胞に、異物であるというマークを付けることで、マクロファージなどの食細胞が食べやすくなります。
ホメオドメイン転写因子
ホメオティック遺伝子群(Hox 遺伝子群と呼ばれ、Hoxa、Hoxb、Hoxc および Hoxd という4つのクラスターに編成されている)は、
胚段階で体節にかかわる構造(胚発生において体幹に発生する、前後軸に分節した中胚葉性の構造物のことを指す)
全ての系統に亘って存在し、一般に皮節・筋節・硬節へと更に分かれたのち、真皮や骨格筋、骨格や体幹の脊髄神経など様々な要素に分化する。
脊椎動物の体の形態を決定づける上で極めて重要な構造であると言える。
ホメオドメイン転写因子とは、ホメオティック遺伝子群により生産されたタンパク質で、
転写因子 (transcription factor) として知られるタンパク質のクラスに属し、これらは全てDNAに結合する機能を持ち、これによって遺伝子の転写を制御できる。
ホメオボックスの塩基配列がコードする、60のアミノ酸から成る
ヘリックスターンヘリックスタンパク質は
ホメオドメインフォールド(あるいは単に「ホメオドメイン」)として知られるものである。
このホメオドメインは、エンハンサーと呼ばれる特定の塩基配列に結合し、転写をオン・オフする、いわばスイッチであり、結合により遺伝子を活性化する場合も抑制する場合もある。
同一のホメオティックタンパク質が、ある遺伝子では抑制的に働き、他の遺伝子では促進的に働くことが可能である。
ホメオドメインが結合するエンハンサーの塩基配列
ホメオドメインタンパク質が結合するDNA塩基配列は TAAT というヌクレオチド配列を持ち、この5'端の T が結合には最も重要である。
この配列はホメオドメインに認識される部位ではほとんど全て保存されており、おそらくこれらの部位をDNAへの結合部位として識別していると考えられる。
この初期配列に続く塩基対配列は、同じ部位に結合する全てのホメオドメインタンパク質で共通して認識のために使っている。
例として、 TAAT 配列に続くヌクレオチドは、ホメオドメインタンパク質の9番目のアミノ酸により認識される。
Bicoidタンパク質ではこの位置はリシンであり、これはヌクレオチドのグアニンを識別し結合する。
アンテナペディアタンパク質ではこの位置はグルタミンが占めており、アデニンを識別し結合する。Bicoidのリシンがグルタミンに入れ替わると、この変異タンパク質はアンテナペディア結合エンハンサーの部位を認識するようになる。
ホメオティック遺伝子群の制御
ホメオティック遺伝子がリアライゼーター遺伝子を制御するのと同様に、これらは、今度ギャップ遺伝子群 (gap genes) とペアルール遺伝子群 (pair-rule genes) によって制御され、さらにこれらは、母方から供給されたメッセンジャーRNAにより制御される。
結局これらは次のような転写因子カスケードを構成する。
母系メッセンジャーRNAがギャップおよびペアルール遺伝子群を活性化し、ギャップおよびペアルール遺伝子群がホメオティック遺伝子群を活性化し、最後にリアライゼーター遺伝子群を活性化し、これらが発生中の胚の中の節の分化を引き起こす。
制御は 形態形成場と呼ばれるタンパク質濃度の勾配を通じて実現される。
例えば、母方由来のあるタンパク質の高濃度と他のタンパク質の低濃度が、ギャップまたはペアルール遺伝子群の特定の組を活性化する。
ハエでは胚の第2縞が母方由来の Bicoid と Hunchback で活性化され、逆にギャップタンパク質の Giant と Kruppel により抑制される。
従って、第2縞は、 Bicoid と Hunchback が存在し、Giant と Kruppel が存在しない場所でのみ形成される。
ホメオティック遺伝子クラスター内にコードが位置しているmiRNAストランド (1本鎖短RNA)は、もっと前方のホメオティック遺伝子群を抑圧することが示されている (「後方発現現象」)。
恐らくこれは、表現型を微調整するためのものであろう。
ノンコーディングRNA (ncRNA) は、ホメオティック遺伝子クラスター内に豊富に存在することが示されている。ヒトでは 231 のノンコーディングRNAが存在している。
そのうちの一つである HOTAIR は、Polycomb-group タンパク質 (PRC2)に結合することにより転写を抑制する (これはホメオティック遺伝子クラスター HOXC から転写され、後方にある HOXD 遺伝子群を抑制する)。
転写にはクロマチン構造が不可欠であるが、クラスターが染色体領域の外でループを描くことも必要である。
定量的 PCR 法は、コリニアリティー(en:Collinearity)と関係していると考えられるいくつかの傾向を明らかにしている。
つまり、システムは平衡状態にあり、転写の総数は存在する遺伝子の数と線形関係にあるということである。
ホメオボックス(homeobox)
動物、植物および菌類の発生の調節に関連する相同性の高いDNA塩基配列である。
ホメオボックスを持つ遺伝子はホメオボックス遺伝子と呼ばれ、ホメオボックス遺伝子ファミリーを構成する。
ホメオボックスはおおよそ180塩基対があり、DNAに結合しうるタンパク質部位(ホメオドメイン)をコードする。
ホメオボックス遺伝子は、例えば足を作るのに必要なすべての遺伝子など、典型的に他の遺伝子のカスケードをスイッチする転写因子をコードする。
ホメオドメインはDNAへ特異的に結合する。
しかしながら、単独のホメオドメインタンパク質の特異性は通常、その要求される標的遺伝子だけを認識するに充分ではない。
ほとんどの場合、ホメオドメインタンパクは他の転写因子また、しばしばホメオドメインタンパク質との複合体としてその標的遺伝子のプロモーター領域で働いている。
そのような複合体は単独のホメオドメインタンパク質よりも高度な標的特異性を持つ。
ホメオボックス遺伝子は胚発生でも重要な役割を果たす。
ホモログ(相同)
生物情報学などでは、タンパク質やDNAでの相同性は、配列類似性に基づいて判断される。
例えば、2つの遺伝子がほとんど同一のDNA配列をもっている場合、それらはおそらく相同であろう。
しかし、その配列類似性は、共通の祖先をもつことが原因ではないかもしれない。
すなわち、短い配列が偶然に類似している、ということかもしれないし、例えば転写因子のように、特定のタンパク質と結合できるような配列が選択されたから、配列が類似している(つまり収斂進化)のかもしれない。
そのような配列は、類似しているが、相同ではない。
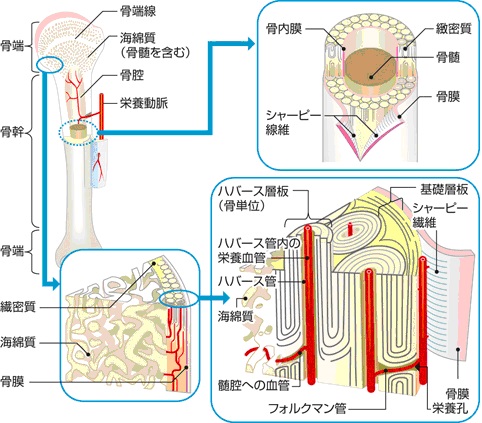
骨の構造
 ▼ ハ行先頭へ
▼ ハ行先頭へ