カ行
会合構造
会合とは、同種の分子が分子間力によって2個以上結合し、一つの分子(単位)のように行動する現象。
また、このような単位を会合体と呼ぶ。
単位を構成する分子数によって二量体,三量体などと呼ぶ。
化学受容器 圧受容器
化学受容器は、生物が化学物質を検知して認識する場合の認識(例えば神経インパルスの発生)などを引き起こすために最初に化学物質が接触する生物側の装置。
例としては,味覚レセプター,嗅覚レセプターなどで,これらは現在タンパク質であることがわかっています。
圧受容器は、血管にかかる圧力を感受する神経の終末。
血管壁のゆがみなどを検知する生体の機能で,血圧調節の一つの仕組みといえる頚動脈洞や大動脈弓の壁に局在する。
血圧の調整
頸動脈には化学受容器として頸動脈小体と圧受容器をもつ大動脈洞があり、大動脈弓にも化学受容器の大動脈小体と圧受容器を持つ大動脈洞と呼ばれる受容器が存在し、インパルス(活動電位)を発しています。
頸動脈小体や大動脈小体は、血液中の酸素分圧や二酸化炭素分圧およびpHをモニターし、それぞれ、舌咽神経と迷走神経を介して情報を延髄の心臓血管中枢に入力します。
酸素分圧が低下し、二酸化炭素分圧が上昇し、pHが低下すると頸動脈小体や大動脈小体は心臓のペースメーカーの洞房結節を刺激して心拍数を上げ、心拍出量を増加させるので血圧は上昇します。
一方、血圧上昇期には頸動脈洞や大動脈洞の圧受容器からのインパルスの発生は抑制され、血管は拡張され血圧は低下します。
化学遊走(化学誘引)
運動性の細胞が、生体(単一の細胞や多細胞の生物体を問わず、細胞や細菌など)の周囲に存在する特定の化学物質の濃度勾配に対して方向性を持った行動を起こすこと。
走化性
生物体(単一の細胞や多細胞の生物体を問わず、細胞や細菌など)の周囲に存在する特定の化学物質の濃度勾配に対して方向性を持った行動を起こす現象のことであり、化学走性(かがくそうせい)ともいう。
この現象はたとえば細菌がブドウ糖のような栄養分子の濃度勾配のもっとも大きな方向に向かって移動するために、あるいはフェノールのような毒性物質から逃げるために重要である。
多細胞生物でも走化性は通常の生命活動においてだけでなく、その生命の初期(たとえば受精の際の精子の卵への運動)やそれに続く諸段階(神経細胞やリンパ球の遊走など)にも必須の性質である。
しかし
がんの転移では、動物の走化性を起こす機構がくずれることもわかっている。
対象となる化学物質の濃度勾配に対し、それが高い方向へ運動することを「正の走化性」とよび、その逆への運動は「負の走化性」とよばれる。
走化性研究の歴史
好中球は人体の細菌感染に対する最初の防御線である。
切り傷や擦り傷が生じると、好中球は付近の血管から外に出て細菌が産生する化学物質を認識し、その「においの方向」へと遊走する。
この好中球はある種の細菌が産生するペプチド鎖FMLP(Nホルミルメチオニルロイシルフェニルアラニン)の濃度勾配にしたがって並んでいたのである。
細胞遊走はすでに顕微鏡が発明された当初から知られていた(レーウェンフック)が、最初の学術的な記述は細菌についてT.W.エンゲルマン(en:Theodor Wilhelm Engelmann)(1881)およびW.F.プフェファー(en:Wilhelm Pfeffer)(1884)に、繊毛虫についてH.S.イェニングス(en:Herbert Spencer Jennings) (1906)によって行われた。
ノーベル医学・生理学賞を受賞したメチニコフも、(受賞研究である)食作用の最初の段階としての走化性について研究を行い、この分野に貢献している。
1930年代には生物学や臨床病理学において、走化性の重要性が広く受け入れられるようになった。
この現象に関する基本的な定義のほとんどもこの時期に作られている。走化性分析法(ケモタクシスアッセイ)の質的管理の上で最も重要な部分は、1950年代にヘンリー・ハリスによって記述された。
1960年代および70年代には細胞生物学と生化学で革命的発展があり、さまざまな新しい技術によって走化性応答細胞の遊走の様子や、その際走化性活動にかかわる細胞よりも小さなレベルの部分まで研究が可能となった。
ジュリアス・アドラーの先駆的業績に、走化性にかかわる細菌の細胞内シグナル伝達過程全体を理解する上での重要な転機が描かれている。
2006年11月3日にケンブリッジ大学のデニス・ブレイ(en:Dennis Bray)は大腸菌の走化性に関する研究でマイクロソフト賞(en:Microsoft Award)を受賞している。
化学誘引物質(Chemoattractant, 化学遊走物質とも)と
化学忌避物質(Chemorepellent)
運動性の細胞にそれぞれ正または負の走化性を引き起こす効果を持った無機物あるいは有機物である。
化学誘引物質の効果は既知あるいは未知の走化性受容体を通して発現するが、あるリガンドが化学誘引物質の側面を持つかどうかは標的細胞に対して特異的であり、濃度依存的である。
もっともよく研究されている化学誘引物質はホルミルペプチドとケモカインである。
化学忌避物質への反応は体軸性の泳動となって現れるが、これは細菌の基本的な運動現象と考えられている。
化学忌避物質として最もよく研究されているのは無機塩類、アミノ酸およびケモカインである。
細菌の走化性
大腸菌のようなある種のバクテリアには鞭毛が(一般には一細胞あたり4-10個)ある。
この鞭毛は二通りの回転を行う
1.反時計回転を行うと鞭毛は一まとまりとなり、細菌は直線的に泳ぐことが可能となる。
2.時計回転では鞭毛の束が、ばらけて各鞭毛がばらばらの方向を向き、その結果細菌はその場でランダムな方向転換(タンブル)をする。
行動
細菌の運動はすべてタンブルと泳ぎの相が交互に組み合わさった結果である。ある決まった環境の下で細菌の泳ぎを観察すると、比較的まっすぐな泳ぎがランダムな方向転換(タンブル)で中断される、というランダムウォークのような運動をしているのがわかる。
大腸菌のような細菌は泳ぎの方向を自ら決めることはできず、回転の拡散のために数秒程度しかまっすぐに泳ぐこともできない。細菌は自分の進む方向を忘れてしまう、といってもよい。
このような制約を受けているものの、細菌は誘引物質(普通は食物)の濃度が高い好ましい方向を見けたり、忌避物質(普通は毒物)から逃げるために自分の運動を決めることができることは重要である。
化学濃度勾配の存在下で細菌は走化性、つまり濃度勾配に基づいた向きへの運動をおこなう。
細菌が自分の運動の向きを正しい(誘引物質に向かっている、または忌避物質から逃げている)と感じると、タンブル運動に転ずるまでの直線的な泳ぎをより長く続ける。
逆に間違っているときは、より早くタンブルに転じてランダムに新たな方向をさがす。
つまり大腸菌などの細菌は、自らの生命がよい状況下にあるか危機にさらされているかを決定するためのとっさの判断を行う。
こうして誘引物質の濃度が最も高い場所(普通はその物質そのもの)を手際よく見つけるのである。
その物質の濃度が非常に高い場合でも、ごく小さな差異を弁別することが可能である。
この能力は忌避物質から逃げる場合にも同じ効果をあげる。
この目的性を持ったランダムウォーク(バイアス-ランダムウォーク)が二つのランダムな運動、タンブルと直線的な泳ぎのどちらかを選択しただけによる結果だということは、注目すべきことのように思われる。
実際方向を「忘れ」たり運動を「決定」するという走化性の反応は、より高次な生命体の感覚情報を持った脳が意思決定能力を持っているのと似ている。
このような運動が起こるためには、一つ一つの鞭毛フィラメントのらせん状の性質が重要である。
鞭毛フィラメントを形成するタンパクであるフラジェリンは、そのものが非常にらせん菌に似ている。
このよく保存されたフラジェリンタンパクを認識するようにデザインされた免疫受容体(
TLR5)を脊椎動物は持っており、これをうまく利用しているといえる。
シグナル伝達
化学物質の濃度勾配を検知するのは種々の膜貫通型受容体でメチル基受容走化性タンパク質(methyl-accepting chemotaxis proteins, MCPs)と呼ばれ、探知する分子ごとに異なっている。
大腸菌では、MCPはアスパラギン酸受容体 (Tar)、セリン受容体(Tsr)、リボース/ガラクトース受容体(Trg)、ジペプチド受容体(Tap)の4種類である。
この受容体は誘引物質や忌避物質と直接間接に結合し、細胞膜周囲腔(グラム陰性菌の細胞膜と外膜の間、グラム陽性菌ではそれに該当する区域)のタンパク質と相互反応する。これら受容体からのシグナルは細胞膜を経由して細胞質内に伝達され、Cheタンパクが活性化される。Cheタンパクはタンブルの頻度と受容体の変化を起こす。
鞭毛の制御
CheWタンパクおよびCheAタンパクは受容体に結合している。
外部刺激による受容体の活性化は、ヒスチジンキナーゼであるCheAの高度に保存された1ヒスチジン残基を自己リン酸化(プロテインキナーゼ#概要参照)する。
CheAは続いてリン酸基を応答調節因子のCheBおよびCheYに保存されたアスパラギン酸残基へと転移する(CheAはヒスチジンキナーゼであってリン酸基をアクティブに転移するわけではなく、応答調節因子CheBがリン酸基をCheAから奪うかたちである)。
このシグナル伝達の機構は二成分制御系(two-component regulatory system)と呼ばれ、細菌におけるシグナル伝達の一般的な形態である。
CheYタンパクは鞭毛のスイッチタンパクであるFliMと相互反応して、鞭毛の回転を反時計回転から時計回転へと変えることでタンブルを誘導する。
一つの鞭毛の回転状態が変わることで鞭毛全体の束が乱れ、タンブルが起きるのである。
受容体の制御
CheBタンパクはCheAに活性化されると脱メチル化酵素として働き、受容体の細胞質側にあるグルタミン酸残基を脱メチル化する。
一方CheBと拮抗的に働くCheRはメチル基転移酵素で、同じグルタミン酸残基をメチル化する働きがある。
受容体のメチル化されるグルタミン酸残基が多くなるほど、受容体の感受性は低下する。受容体からのシグナルがフィードバック回路として受容体の脱メチル化を起こすので、この制御系はつねに環境中の化学物質濃度に対して補正を行って、高濃度下の環境でもわずかな変化に対する感受性を保つことができる。
この制御系のおかげで細菌は少しだけ、数秒だけ前の物質の濃度を「記憶し」て現在のそれと比較することができ、濃度勾配に対して遡るか下るかを「判断する」ことができるのである。
このメチル化の機構は、細菌が物質の濃度に対して持つ広範囲の感受性を説明できるが、ある条件下で感受性の絶対値が増加する点は別の機構による説明が必要である。
リン酸化型CheY(CheY-P)に対するモーターの超感受性応答と受容体のクラスター化がある。
真核生物の走化性
真核生物の化学走性機構は細菌のそれとはまったく異なっているが、化学物質の濃度勾配を感知することが決定的に重要である点は同様である。
原核生物は大きさに制限があるため、濃度勾配をうまく検知することができない。
そのためつねに泳ぎ回って(直線的泳ぎとタンブルの繰り返しによって)自己の環境をスキャン・評価している。
原核生物とは対照的に真核生物は濃度勾配検知を行えるだけの十分な大きさがあり、化学受容体が動的・局在性に分布している。
化学誘引物質や忌避物質によってこの受容体が誘導されることで、走化性物質に向かって移動したりそれから逃げたりすることになる。
受容体や細胞内シグナル伝達経路、効果器メカニズムの進化の違いが、すべて多様な真核生物の化学走性機構にかかわっている。
真核単細胞生物ではアメーバ運動と繊毛(あるいは真核生物鞭毛)が主な効果器である(たとえばアメーバやテトラヒメナ)。
より進化した脊椎動物由来の真核細胞の中にも、
免疫細胞のように必要とされる場所へ移動するものがある。
免疫担当細胞(顆粒球、単球、リンパ球)以外にも、従来は組織中に固定されていると考えられていた多くの細胞が特定の生理的(正常な)条件下(肥満細胞、線維芽細胞、血管内皮細胞)や病理学的(病的な)条件下(転移など)で移動することがわかっている。
走化性は胚発生の初期段階においても胚葉の発達がシグナル分子の濃度勾配に誘導されて起きるという点で重要な意味を持っている。
運動性
細菌の走化性とは対照的に、真核細胞が移動するメカニズムは解明が不十分である。
外部からの走化性濃度勾配を感知する機構が存在するらしく、それが細胞内のホスファチジルイノシトール三リン酸(PIP3)という物質の濃度勾配となり、シグナル伝達によって最終的にアクチンフィラメントの重合が起きる。
アクチンフィラメントの+端(成長する側、アクチンの項を参照)は様々なペプチドを通じて細胞膜の内側と連結し、仮足を形成する。
PIP3の産生がDOCK2と呼ばれるタンパク質の細胞膜への集積を起こし、さらにホスファチジン酸というリン脂質が産生されDOCK2と結合することで仮足形成が効率的に進むことが明らかになっている。
真核細胞の繊毛も化学走性を起こす。この場合は主にCa2+(カルシウムイオン)依存性に、基底小体と9+2構造の微小管からなるシステムが繊毛運動を誘導される。
数百に及ぶ繊毛が、基底小体相互間に作られた細胞膜下のシステムによって協調運動を行うが、シグナル伝達経路の全容は未解明である。
走化性と関連した移動反応
走化性は移動形態の中ではもっとも研究が進んでいるが、細胞レベルの運動形態は他にもいくつかある。
ケモキネシスは外部の液体中の分子によって引き起こされる運動だが、この反応には方向性がなくランダムな運動となる。
二点間の移動というよりも自己の周囲をスキャンするという行動なので、この運動は規模も頻度も特徴的ではなく、また方向性もない。
ハプトタキシスは走触性ともいい、走化性では化学誘引物質が溶液中の濃度勾配で与えられるのに対して、細胞表面に提示または結合する。
最も一般的に走触性の活性化を示す例は細胞外マトリクスであり、これが受容体にリガンドとして結合することで血管の内皮細胞を通過して細胞移動や血管新生を誘導する。
ネクロタキシスは走化性の特殊なタイプで、化学誘引物質が壊死細胞やアポトーシス細胞から放出される場合に起こるものをさす。
放出される物質の化学特性によって細胞が集積する場合も遠ざかる場合もあり、生理学的・病理学的な意義はその点にある。
受容体
たいていの場合、真核細胞が走化性刺激の存在を感知するのは7回膜貫通型三量体Gタンパク質共役受容体を介してである。
この受容体のグループは非常に多く、ゲノム中のかなりの部分を占めている。
この遺伝子スーパーファミリーの中には視覚のために使われたり(ロドプシン)嗅覚に使われたりするもの(嗅覚受容体)もある。
走化性受容体に特化したものとしてはホルミルペプチド受容体、ケモカイン受容体(CC受容体とCXC受容体)、ロイコトリエン受容体などがあるが、これ以外の多くの膜受容体(アミノ酸受容体、インスリン受容体、血管作動性ペプチド受容体など)も細胞の移動を引き起こす。
走化性リガンド
走化性反応を惹起しうる分子の数はかなり多いが、一次走化性分子と二次性走化性分子に分けることができる。
一次性リガンドの主なグループとしては以下のものがあげられる。
・ホルミルペプチドはバクテリア由来でアミノ酸2、3、4残基のペプチドである。
これらは生体内で細菌の細胞が分解すると放出される。
主なものとしてN-ホルミルメチオニルロイシルフェニルアラニン(fMLPあるいはfMLFと略される)。
細菌由来のfMLPは好中球や単球に対して特異的な化学誘引効果をもっており、炎症反応で主要な役割を果たす。
・補体C3aおよびC5aは補体経路の中間産物である。
これらは補体系の3つの経路(古典経路、副経路、レクチン経路)でそれぞれ転換酵素によって合成される。
走化性因子としてのC3aとC5aの主な標的も好中球と単球である。
・ケモカインはサイトカインの特殊なグループの一つである。
ケモカイングループ(C, CC, CXCおよびCX3Cケモカイン)は独特なジスルフィド結合の配列を持った構造的に関連がある異なる分子というだけでなく、それぞれの標的とする細胞もそれぞれ異なっている。
CCケモカインは(RANTESのように)単球に作用し、CXCケモカインは(IL-8のように)好中球に特異的に作用する。
ケモカインの三次構造の解析により、βシートとαヘリックスの特徴的な構成がケモカイン受容体との相互作用に必要な配列を表現しているのがわかる。
IL-8などのケモカインでは、二量体が形成され生物活性が増強していることが結晶学的に示されている。
・ロイコトリエンはエイコサノイドの一種であり、アラキドン酸カスケードで5-リポキシゲナーゼによって合成される脂質メディエーターである。
主要な産物であるロイコトリエンB4(LTB4)は白血球の接着、化学走性および凝集を誘発するが、炎症やアレルギー反応時に高度に発現するロイコトリエン受容体(7回膜貫通型Gタンパク共役受容体)を通じて走化性反応を起こす。
核
核は細胞に1つある。
また核内には1つ以上の核小体がある。
細胞の他の部分(細胞質)とは、核膜と呼ばれる2層の脂質二重膜によって隔てられており、核と細胞質間で物質輸送が行われるときには、核膜に空いた多くの穴(核膜孔)を通って行われる場合が多い。
核内には遺伝情報であるDNAのほか、核タンパク質、RNA(リボ核酸)が含まれており、DNAの遺伝情報は核でRNAに転写される。
核酸
塩基と糖、リン酸からなるヌクレオチドがリン酸エステル結合で連なった生体高分子である。
糖の違い(2位が、水素基(DNA)か水酸基(RNA)であるか)によって、2-デオキシリボースを持つデオキシリボ核酸 (DNA) と、リボースを持つ リボ核酸 (RNA) とがある。
核酸塩基:核酸 (DNA, RNA) を構成する塩基成分で、主なものにアデニン、グアニン、シトシン、チミン、ウラシルがあり、それぞれ A, G, C, T, U と略す。構造の骨格からプリン塩基 (A, G) とピリミジン塩基 (C, T, U) とに分けられる。
カスパーゼ
カスパーゼは細胞にアポトーシスを起こさせるシグナル伝達経路を構成する、一群のシステインプロテアーゼです。
システインプロテアーゼは活性部位にシステイン残基をもつタンパク質分解酵素であり、カスパーゼは基質となるタンパク質のアスパラギン酸残基の後ろを切断する。
Caspaseという名は
Cysteine-
ASPartic-acid-prote
ASEを略したものです。
カスパーゼは他のカスパーゼを切断し活性化するというカスケード(連鎖的増幅反応)の形で機能します。
カスパーゼカスケード
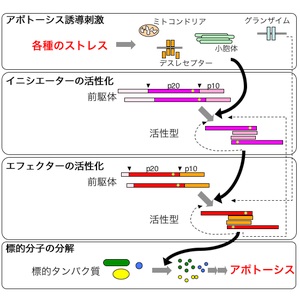
スカスパーゼカスケードには、
ミトコンドリアからの刺激で活性化される経路、
細胞膜表面の受容体からの刺激で活性化される経路、
小胞体からの刺激で活性化される経路、
ストレス誘導分子が直接エフェクターを活性化する経路が存在する。
それぞれについて、それを担当する
イニシエーターカスパーゼは異なるが、いずれの場合も最終的には同様に、
エフェクターカスパーゼである、カスパーゼ-3、-7、-6が活性化される。
カスパーゼは最初は不活性な
前駆体であるプロカスパーゼとして合成され、このかたちで細胞内に存在している。
アポトーシスを誘導する刺激が細胞に加わると、イニシエーター・カスパーゼのプロドメインに結合する分子との相互作用が変化し、その結果、イニシエーター・カスパーゼ分子が集合体を形成する。
この集合体の形成によって、同じイニシエーター・カスパーゼによる切断を受け、活性型へと変化する。
活性化したイニシエーター・カスパーゼは、次にエフェクター・カスパーゼを切断して活性型に変化させる。
そしてエフェクター・カスパーゼは最終ターゲットになる、いくつかの細胞内タンパク質を切断・分解する。
これらの標的タンパク質には、細胞が形を保ち生存していくために重要な役割を持つものが含まれており、これらが分解されることが最終的に
アポトーシス(細胞の死)につながると考えられている。
ミトコンドリアからの経路: DNA損傷などのストレスは、アポトーシス誘導分子p53やアポトーシスを調節するBcl-2ファミリータンパク質を介して、ミトコンドリアの膜電位を変化させ、その結果、ミトコンドリアから
シトクロムcが漏出する。
これが細胞質に存在するApaf-1やカスパーゼ-9と結合して、アポトソーム(apoptosome)と呼ばれる集合体を形成する。
これによって活性化されたカスパーゼ-9が、下流のエフェクターを活性化していく。
細胞膜の受容体からの経路: Fasリガンド、TNFなどのデスリガンドと呼ばれる細胞外タンパク質が、それぞれに対する細胞膜上の受容体(FasおよびTNF受容体)と結合する。
これらの受容体の細胞内領域には、アダプター分子であるFADDが結合しており、さらにカスパーゼ-8がプロドメインを介してFADDと結合している。
受容体へのリガンドの結合によって、まずプロドメインが切断され、さらに自己切断によって活性化されたカスパーゼ-8が下流のエフェクターを活性化していく。
また、カスパーゼ-8によって活性化されるBidと呼ばれるタンパク質はカスパーゼ-9を活性化する経路にも作用する。
この経路では、カスパーゼ-8以外に、アダプター分子を介してデスレセプターと結合するカスパーゼ-10や-2もイニシエーターとして働く。
小胞体からの経路:細胞内に異常なタンパク質が蓄積したり、糖やカルシウム代謝などに異常を生じると、細胞は
小胞体ストレス応答と呼ばれるストレス応答を行って対処するが、ストレスが過剰な場合にはアポトーシスが誘導される。
エフェクターを直接活性化する経路:T細胞が放出するグランザイムBが、同様に放出されるパーフォリンなどの働きによって、細胞質内に侵入すると、カスパーゼ-3、-7などのエフェクター・カスパーゼを直接活性化していく。
またグランザイムBはカスパーゼ-8、-10などのイニシエーター・カスパーゼを活性化する経路にも作用する。
カスパーゼの最終ターゲットには、細胞核内のラミン、ICAD/DFF45、ポリ(ADP)リボースポリメラーゼ (PARP)、PAK2などがあり、これらの分解によって細胞がアポトーシスを起こすと考えられているが、アポトーシスに伴う細胞の生化学・形態学的変化にそれぞれどの程度寄与しているかは明らかでない。
活性酸素のシグナル伝達機能
(文科省科研費 新学術領域研究)
好気性生物は、酸素分子の化学的反応性(酸化還元:redox活性)を利用してエネルギー代謝を効果的に行うことにより高度な生命活動を営んでいます。
活性酸素は生体内のエネルギー代謝や感染防御過程において発生する一連の反応性分子種(O2 ̄, H2O2等)であり、これまで酸素毒性の要因となる有害物質として取り扱われてきました(活性酸素毒性説)。実際、活性酸素は、感染、炎症、がん、動脈硬化・糖尿病などの生活習慣病や代謝性疾患、アルツハイマー病などの神経難病などの様々な疾病の病因となることが示唆されています。
しかしながら、これまで抗酸化物質を用いた各種疾病の予防・治療の臨床応用は期待される程の成果を上げていないのが現状です。
一方、
生体内には Nox(およびDuox)と呼ばれる酵素群があり、白血球の抗菌作用のみならず、血管系、上皮・内分泌系細胞やリンパ球など多彩な細胞において積極的に活性酸素を産生し殺菌作用以外の生理機能を発揮していることが分かってきました。
また、
過酸化水素(H2O2)が血管平滑筋弛緩をもたらすシグナルとして機能していることも示唆されています。
さらに、活性酸素関連分子である
一酸化窒素(NO)は活性酸素と反応することにより化学的に毒性が高まることが知られておりますが、実際は
生体内で細胞保護シグナルとして重要な情報伝達を司っています。
これらの事実から、生体分子を非特異的に損傷する悪玉としての活性酸素の従来の理解は一変しました。
すなわち、幅広い生命科学領域において、『
活性酸素による生理的なシグナル伝達機能』の解明が飛躍的に進展しています。
本新学術領域研究においては、『活性酸素毒性説』の古い概念から進化した新たなパラダイムとして『活性酸素による生理的なシグナル伝達機能』の解明を目指し、化学と生物系が融合したケミカルバイオロジーという新興の学術融合領域から多くの革新的な成果が上げられることが期待されています。
具体的な研究戦略としては、以下の、a. 活性酸素シグナル形成、b. センサー機能制御、c. エフェクター機能制御の3つのシグナル伝達経路ごとに研究項目を設定して、プロジェクト型研究を推進します。
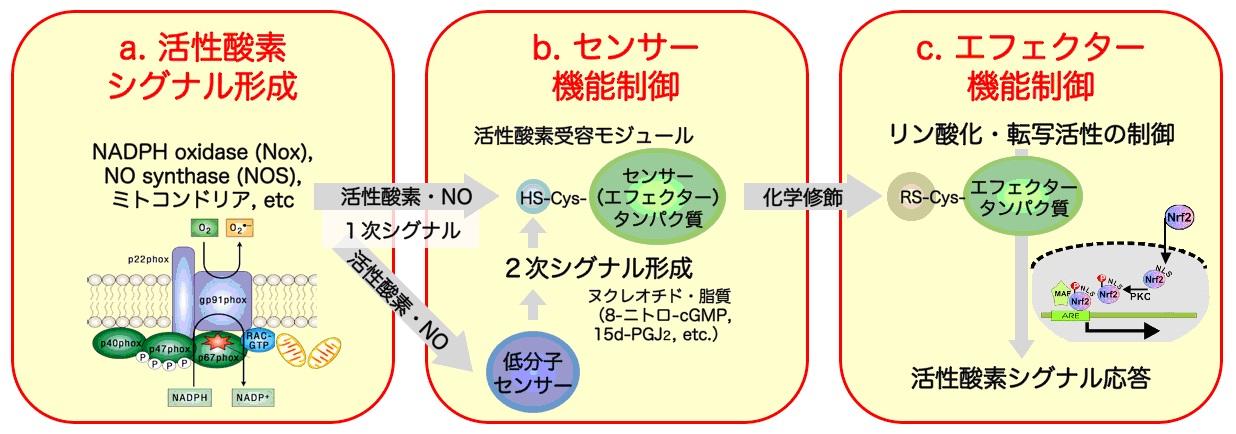 a. 活性酸素シグナル形成
a. 活性酸素シグナル形成
活性酸素は、多くのシグナル分子と異なり構造の簡単な低分子無機化合物です。そのシグナル機能の特異性は、活性酸素産生機構と化学的反応性、特に、分子反応環境を規定する時空間特性に依存しています。
従って、様々な細胞・組織において、
シグナル機能を担って発現されている活性酸素産生酵素(Nox等)の構造機能解析および細胞内局在と時空間的な産生動態を解明することが、活性酸素のシグナル形成とセンシングの分子機構の理解に必須であると考えられます。
従って、シグナルリガンドとしての活性酸素産生機構を理解することは極めて重要ですが、そのシグナル・センサー連関の時空間制御については全く分かっていないのが現状です。
そこで本領域研究においては、Noxやミトコンドリアによる活性酸素産生制御機構を時空間的に解析し、活性酸素シグナル形成の全貌を明らかにします。
特に、実際の活性酸素産生の細胞内局在を特異的蛍光プローブを用いて検出・イメージングすることにより、活性酸素シグナルのセンサー・エフェクター分子との相互作用を細胞および個体レベルで解明いたします。
b. センサー機能制御
活性酸素のシグナル伝達経路において、不安定な1次シグナルである活性酸素は特異的で安定な2次的なシグナル分子に変換されます。
この際、活性酸素を鋭敏に感知する化学センサー分子(核酸・ヌクレオチド、脂質、タンパク質の活性側鎖)が細胞内に存在すると考えられます。
例えば、活性酸素・NOによる核酸や脂質などの低分子センサーとの反応では、安定な2次シグナル分子(8-nitro-cGMPや15d-PGJ2等)が形成されます。
また、レドックス活性の高いシステイン(Cys)モチーフを有するセンサータンパク質が、活性酸素シグナルの受容体機能を直接もしくは間接的に担っています。
この様なセンサー分子の同定と構造・機能解析は、活性酸素のセンシングの特異性を理解する上で大変重要です。
そこで、活性酸素・NOのセンサー分子の同定と化学センシング機構の解明を行います。また、活性酸素シグナルあるいはその2次シグナル分子を受容した(化学修飾を受けた)センサー・エフェクタータンパク質の構造・機能を解析し、さらに、新規センサーの探索を行います。
このことにより細胞内シグナル伝達における活性酸素・NOによる多様なセンシング機構を明らかにいたします。
c. エフェクター機能制御
活性酸素による直接的な、または、低分子2次センサーを介する間接的なシグナル受容に引き続くエフェクターの活性化は、自身がエフェクターとしても機能するセンサータンパク質の分子構造変化によって誘発されると考えられます。
すなわち、
エフェクターとしてのリン酸化・脱リン酸化酵素や転写因子の化学修飾(Cys酸化、ニトロソ化、アルキル化等)によるリン酸化シグナルや転写制御などです。
この様なセンサー・エフェクター分子連関の多様性の分子メカニズムの解明は当該分野の重要課題と位置づけられます。
具体的には、活性酸素のセンサータンパク質(ホスファターゼなど)を介するリン酸化シグナル経路と核内シグナル伝達・転写制御機構による細胞応答機構(細胞増殖・細胞死制御)、活性酸素による小胞体ストレス制御、また、血管弛緩因子としての過酸化水素によるシグナル伝達機構を解明いたします。
活性酸素種(ROS)
呼吸で肺から取り込まれて組織に運ばれた酸素は、生体内の穏やかな条件下で反応し易い不安定な形に変わることがあります。この不安定な酸素種を活性酸素種 (Reactive Oxygen Species、略して
ROS)といいます。
活性酸素は他の物質と反応して安定になろうとする性質があります。そのため活性酸素はタンパク質・脂質・核酸などと反応し、酸化して変性してしまうことがあるのです(酸化傷害)。
この点では、活性酸素は“悪玉”ということになります。
代表的な活性酸素にスーパーオキシドラジカル、過酸化水素、ヒドロキシラジカル、一重項酸素などがあります。
このように活性酸素はラジカルであるものも、そうでないものもあります。
活性酸素は、生体内では主にミトコンドリアや種々の酵素反応で産生されますが、酵素が関わらない反応(還元された鉄イオンや銅イオンが触媒になる反応(フェントン反応)でも生じます。
過酸化水素から金属イオン触媒で生じるヒドロキシラジカルは極めて反応性が高くもっとも危険な活性酸素と考えられています。
生体内には鉄イオンが沢山あります。
その多くはヘモグロビンなどにあるヘム鉄という形になっていてそれ自体は危険どころか生命に必須の役割を果たしています。
また、過酸化水素が生じる反応は常に細胞内で起こっていますから、いつも危険と隣りあわせで生きていることになります。
ミトコンドリアは、活性酸素の産生源として特に注目されています。
私たちが呼吸で取り込んだ酸素の90%以上はミトコンドリアで使われます。
この過程で酸素の0.1-2%が活性酸素に変わると考えられています。
カテコラミン(カテコールアミン)
チロシンから誘導された、カテコールとアミンを有する化学種である。
多くの神経伝達物質等(アドレナリン、ノルアドレナリン、ドーパミン)及び関連薬物の基本骨格になっている。
カテプシン
細胞内のプロテアーゼで、主にリソソームに分布し、酸性領域に至適pHをもつ一群の酵素の総称、B、D、E、G,H、M、N、L、Sなどのエンドペプチダーゼ、A、Cなどのエキソペプチダーゼが知られている。
プロテアソームとともに、細胞内でのタンパク質分解に関与している。
解糖系・TCA回路(クエン酸回路)
解糖系(エムデン・マイヤーホフ・パルナス 経路・EMP 経路)とは、生体内に存在する生化学反応経路の名称であり、グルコースをピルビン酸などの有機酸に分解(異化)し、グルコースに含まれる高い結合エネルギーを生物が使いやすい形に変換していくための代謝過程である。
ほとんど全ての生物が解糖系を持っており、もっとも原始的な代謝系とされている。
嫌気状態(けんきじょうたい、無酸素状態のこと)でも起こりうる代謝系の代表的なもので、別名嫌気呼吸(けんきこきゅう)、無気呼吸(むきこきゅう)などとも呼ばれる。
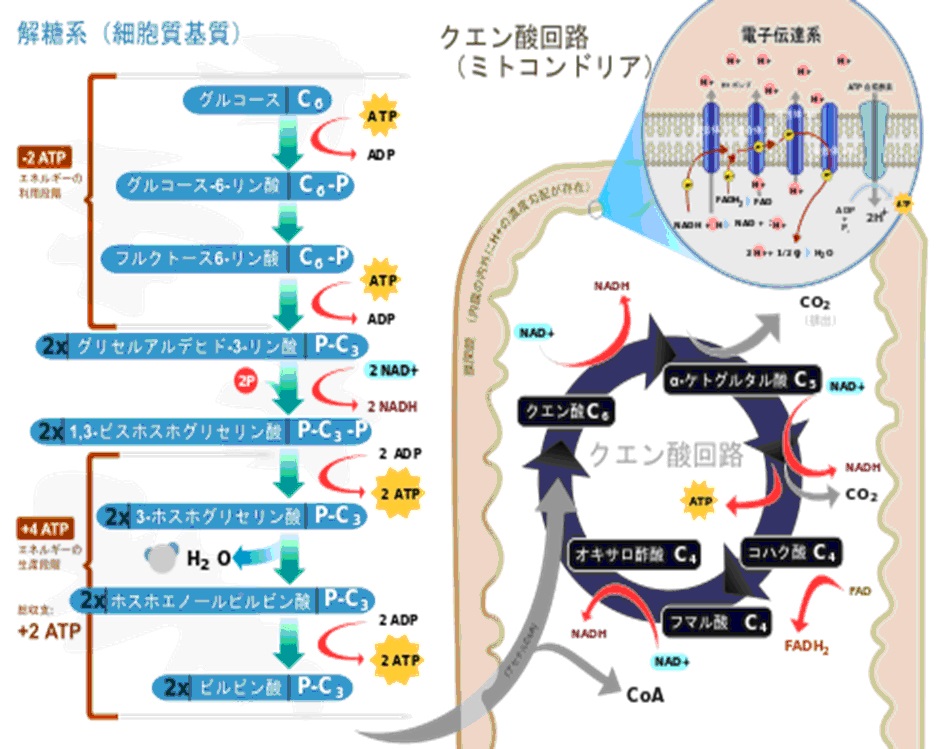
全ての哺乳類は糖(グルコース)を解糖系で代謝しピルビン酸か乳酸を生成する。
もし、酸素が存在しないならば最終産物は乳酸のみである。酸素が存在するならばピルビン酸は代謝されアセチルCoAとなる。
解糖系は酸素が存在しなくても反応は進むが、クエン酸回路の反応は進まない。
これは電子伝達系の反応の最後に酸素が必要になるためであり、酸素がないと反応が完了しないためである。
解糖系の反応は細胞質基質で発生する。
クエン酸経路はミトコンドリア内にあるため、解糖系で産出したピルビン酸を利用する場合、ピルビン酸をミトコンドリア内に輸送しなければならない。
解糖系の反応はグルコースから反応が始まり、ピルビン酸を経由して乳酸を生成する。
glucose→→→ピルビン酸→乳酸
なお、グルコースの炭素数は6で乳酸の炭素数は3である。つまり、グルコース1個が解糖系に入り乳酸に変化すると乳酸は2個できる。
ATP収支
解糖系でグルコース1分子を分解して得られるATPは2分子である。
下の図を見ると、ATP収支は0に思われるがグリセルアルデハイドが2分子生成されるためにATP収支は2分子となる。また、NADHの収支は0になる。
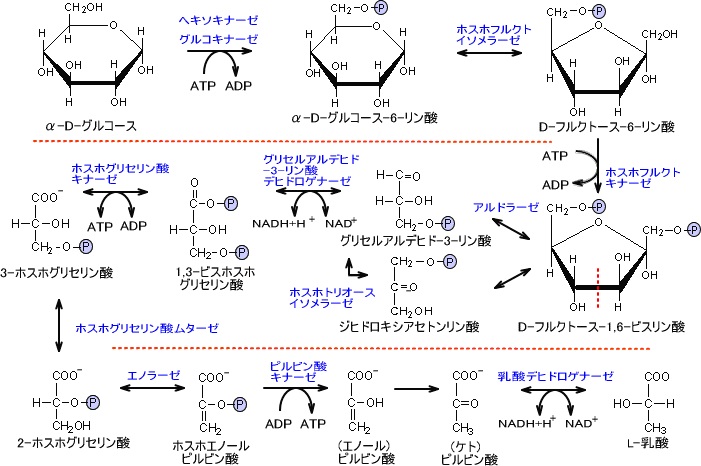
もし酸素が存在する状態であり、反応が乳酸まで進行せずピルビン酸で終わりクエン酸経路に入るならNADHの収支は2である。
アセチルCoAのCoAとはコエンザイムA(補酵素A)のことである。
CoAの構造は、

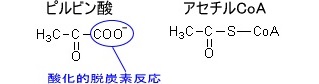
となっている。
ピルビン酸とアセチルCoAの構造はそれぞれである。
ピルビン酸→アセチルCoAへと変化するとき、ピルビン酸のCOO-の部分はCO2として脱離する酸化的脱炭酸反応が起こる。
以下に上図の※部分の反応を示す。
ミトコンドリアに移行したピルビン酸は様々な酵素によって触媒される。
この触媒する酵素の総称をピルビン酸デヒドロゲナーゼ複合体という。
ピルビン酸はピルビン酸デヒドロゲナーゼ複合体によって酸化的炭酸素されてアセチルCoAへと変化していく。
1.ピルビン酸はピルビン酸デヒドロゲナーゼにより脱炭素されTDP(チアミン二リン酸)に変わる。(チアミンとはビタミンB1のことである)
2.ジヒドロポイルトランスアセチラーゼの分子中に含まれているリポ酸によってコエンザイムAと反応しアセチルCoAを生成する。
3.反応したリポ酸の部分はFADによって酸化され反応回路が完成する。
4.FADが還元されFADH2となった後、NAD を酸化してNADHを生成する。
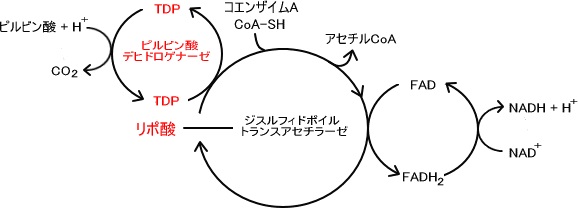
ピルビン酸 NAD CoA → アセチルCoA NADH H CO2
また、この経路は産物であるアセチルCoAとNADHによりフィードバック阻害される。
つまりアセチルCoAとNADHによって反応速度が調節されるのである。ここではアセチルCoAとNADHがアロステリックエフェクターとして働いている。
速度調節
解糖系には一方通行の反応が3ヶ所ある。よって、この部分で速度調節するのが望ましい
・ホスホフルクトキナーゼ(PFK)→クエン酸、ATPで阻害
・ヘキソキナーゼ→G-6-Pがアロステリックに阻害
・ピルビン酸キナーゼ(PK)→ATPで阻害
乳酸の調節
乳酸が生成されるには乳酸デヒドロゲナーゼ(LDH)が必要である。なお、臓器のなかでもLDHの活性が強い臓器とそうでない臓器が存在する。
筋肉など酸素が不足しがちな臓器はLDHの活性が強く、心臓など酸素が豊富な臓器ではこの活性が弱くなる。
顆粒
顆粒球の細胞内に見られる粒状の構造のこと。
体細胞のほぼ小胞に相当する。
小胞(しょうほう)は、細胞内にある膜に包まれた袋状の構造で、細胞中に物質を貯蔵したり、細胞内外に物質を輸送するために用いられる。
代表的なものに、液胞やリソソームがある。
小胞は、脂質膜の化学的な特性上、自然に形成される構造である。
ほとんどの小胞は何かしらの特化した機能を持っており、その機能は小胞内に含まれる物質によって異なる。
カルニチンパルミトイルトランスフェラーゼI(CPT-I)
カルニチンアシルトランスフェラーゼの一つ、長鎖アシルCoAとカルニチンを基質としてアシルカルニチンとCoAにする反応を触媒する酵素、
脂肪酸の代謝に重要な酵素。
カルニチンとカルニチンパルミトイルトランスフェラーゼI(CPT-I)(カルニチンアシルトランスフェラーゼ)
カルニチンは、生体内で脂質を燃焼してエネルギーを産生するに当り、
脂肪酸を燃焼の場であるミトコンドリア内部に運搬する必須の役割を担う。
ヒトの体内においては、カルニチンは主に肝臓、腎臓においてタンパク結合性のアミノ酸のリジンにメチオニンがメチル基を供与する反応を経由し、数段階の反応過程を経て生合成される。
この際に
ビタミンC、鉄、ビタミンB6、ナイアシンが必要とされる。<br>
特に成長時や妊娠中には、カルニチンの必要量が通常時よりも多くなり、また生合成時に必要な各物質も不足気味となる事から外部摂取が推奨されることがある。なお、生合成量は1日10~20mgとされており、体内保有量約20gと比してごく僅かの量である。
食事由来の外部摂取されたカルニチンは腸管において吸収される。
この際、主としてOCTN (Organic cation transporter) レセプターを介して能動的に吸収され、高濃度の場合は一部受動的に吸収される。
正確な吸収率についてはわかっていない。
また尿細管においてもOCTNにより再吸収され、体内で効率よく使われていることが知られている。
カルニチンは体内においてはほとんどが筋肉細胞に存在しており、筋肉細胞内において脂肪酸をミトコンドリア内部に運搬する役割を担う。
その後、脂肪酸は
β酸化を受け酢酸にまで分解されながら、生成したアセチルCoAはクエン酸回路を通じてエネルギーに転換される。
この脂肪酸は主に存在比率の多い長鎖脂肪酸であり、中鎖脂肪酸はカルニチンと結合せずにミトコンドリア膜を通過できることが知られているが、カルニチンと結合されてミトコンドリア内部に運搬されている中鎖脂肪酸も存在する。
脂肪酸は細胞質ではコエンザイムA(CoA)と結合したアシルCoAの状態で存在するが、ミトコンドリア内膜を通過する際にはカルニチンと結合したアシルカルニチンの状態となっている。
この転換の反応はミトコンドリア膜に存在する酵素により触媒されている。
1)アシルCoAはミトコンドリア外膜に存在する酵素
CPT-Ⅰ(カルニチンパルミトイルトランスフェラーゼⅠ(またはカルニチンアシルトランスフェラーゼともいう))の作用により、カルニチンと結合したアシルカルニチンへと転換される
2)アシルカルニチンはCACT(カルニチン-アシルカルニチントランスロカーゼ)を通過して、ミトコンドリア内部に運搬される。
3)ミトコンドリア内膜内部に存在する酵素CPT-Ⅱ(カルニチンパルミトイルトランスフェラーゼⅡ)の作用により、アシルカルニチンはアシルCoAへと転換される。
4)フリー体となったカルニチンは細胞質に戻る。
L-カルニチンの摂取
体内には約20gのカルニチンがほとんど筋肉細胞に存在する。
1日のカルニチン生合成推定量は10~20mgであり、大部分は肉食により補給される。
「L-カルニチンはアミノ酸の L-リジンと L-メチオニンから生合成されるので、成長期あるいは出産期以外には特に補給する必要はない」という意見もあるが、上述の通り生合成量はわずかであり、主に食事により摂取されるものが大部分である。
L-カルニチンはビタミンではないものの、conditional nutrientとしてコリン、イノシトールやタウリンなどとともに重要な栄養素として位置づけられている[1]。利用しやすい食材の中では、ヒツジ肉や牛肉など赤身の肉に比較的豊富に含まれる。
カルパイン(calpain)
カルシウムに依存して活性化されるシステイン・プロテアーゼ(活性中心にシステイン残基をもつ)で、調節サブユニットと活性サブユニットの二量体として存在する。
カスパーゼのプロセッシングやリソソームの崩壊とカテプシンの放出などを介して細胞死を誘発する。
カルパインは、Ca2+依存的に基質を限定的に切断(プロセシング)する細胞内プロテアーゼです。
故 鈴木紘一先生率いる東京都臨床医学総合研究所の遺伝情報部門は、カルパインの全構造を世界で最初に決定し、これがCa2+-シグナリングの一角を成すバイオ・モジュレータの一つであることを明らかとして、世界の注目を集めていました。
従来から主に研究されていたのは、組織普遍的に存在するμ-及びm-カルパインであり、生命にとって基本的かつ必須な機能を担います。
即ち、細胞内の基質に直接作用し、その機能・活性・構造を変換する細胞内モジュレータ・プロテアーゼと言えます。
これまでに
癌化、記憶、虚血障害、加齢に伴う腎障害、胃のストレス応答による出血・潰瘍、肺気腫、緑内障、筋ジストロフィーなど様々な生命現象にカルパインの関与が報告されています。
ガレクチン-9
TIM-3を発現するヒトの白血病幹細胞がそのリガンドであるガレクチン9を自己分泌することにより、白血病幹細胞それ自体にTIM-3シグナルを生じるという機構を見出しました。
このTIM-3シグナルは、TIM-3陽性の白血病幹細胞においてがん幹細胞の自己複製において重要な役割を担うことの知られているNF-κBとβカテニンの共活性化を生じていました。
さらにこの自己分泌機構は、急性骨髄性白血病のみならずヒトの骨髄系腫瘍の全般においてTIM-3陽性の造血幹細胞がクローンの大きさを拡大させていく過程において機能している可能性が示唆されました。
がん(癌)遺伝子
ある正常な遺伝子が修飾を受けて発現・構造・機能に異常をきたし、その結果、正常細胞のがん(癌)化を引き起こし、
がん(癌)化を促進する機能を持つ遺伝子のことをいう。このとき、
修飾を受ける前の遺伝子をがん原遺伝子と呼ぶ。
がん原遺伝子はシグナル伝達を引き起こす遺伝子であり、通常は翻訳されたタンパク質を介して細胞分裂のシグナルの引き金を引く。遺伝子が活性化されると、
遺伝子自身あるいは翻訳タンパク質は悪性腫瘍の誘導因子が
がん遺伝子になる。
がん(癌)抑制遺伝子
がんの発生を抑制する機能を持つタンパク質(がん抑制タンパク質)をコードする遺伝子である。
特に有名ながん抑制遺伝子として、p53、Rb、BRCA1などが挙げられる。
2倍体の細胞において2つのがん抑制遺伝子両方が損傷することなどにより、結果として
がん抑制タンパク質が作られなくなったり、損傷遺伝子からの異常ながん抑制タンパク質が正常がん抑制タンパク質の機能を阻害すると、組織特異的にがん化が起きると考えられている。
今までに、十数以上のがん抑制遺伝子が知られており、組織特異的であることが多い。
ただしp53の変異は大腸癌、乳癌など非組織特異的とみられる。
一方、Rbの変異は網膜芽細胞腫、骨肉腫など、BRCA1の変異は家族性乳がん、子宮がんなど、MSH2の変異は大腸癌などに見られる。
これらのがん抑制タンパク質の機能は細胞周期チェックポイント制御、転写因子制御、転写、DNA修復など多岐にわたっている。
γ-Sm(γ-セミノプロテイン、gamma-seminoprotein)
γ-Smは精漿から抽出された前立腺組織に局在する前立腺特異抗原のひとつです。
血中γ-Smは前立腺癌に対する特異性の高い腫瘍マーカーであるが、
前立腺肥大症では疑陽性率が高いため他の前立腺腫瘍マーカーと伴に用いられます。
還元反応
生体内では酵素反応により還元反応が進行することが知られている。
ほとんどの還元酵素はニコチンアミドアデニンジヌクレオチド (NAD) あるいはフラビンアデニンジヌクレオチド (FAD) を水素供与体(還元剤)として利用する。
間葉系幹細胞
間葉に由来する体性幹細胞。
間葉(かんよう、英:Mesenchyme)または間葉系結合組織は、胚のすべての3つの胚葉から派生した胚内の未分化の疎性結合組織の一種である。
間葉は、個体発生のごく初期に内胚葉・外胚葉の間に落ち込んだ細胞から生じる非上皮性組織で、突起によって連絡し合って細網線維細胞および未分化細胞の緩やかな集合体とその間を満たす細胞間物質によって形態学的な特徴としている。
間葉細胞は、骨、軟骨、リンパ系、循環器系などの結合組織に発展することができる。
器質化
体内に入ってきた異物や体内でつくられる病的物質(血栓・壊死(えし)組織など)を肉芽組織が取り囲み、吸収などの処理をする現象。
グアニン(guanine)
分子式が C5H5N5O の、
核酸を構成する5種類の主な塩基のうちのひとつ。プリン塩基である。
DNA、あるいはRNAの二重鎖構造の中ではシトシンと3本の水素結合を介して塩基対を作っている。
グアニンから誘導されるヌクレオシドはグアノシン。
グアノシン一リン酸 (GMP)、 グアノシン二リン酸 (GDP)、 グアノシン三リン酸 (GTP)
クラスⅠMHC
自分の目印(自己)はクラスⅠMHC分子というタンパク質でつくられています。
クラスⅠMHC分子は、“細胞”が“自分の細胞”であることを証明する目印となるタンパク質で、ほとんどの細胞の表面にあり、その立体的なカタチは一人一人で異なります。
このクラスⅠMHC分子が同じなら、私の仲間(自己)認められますが、カタチが異なるクラスⅠMHC分子を持つ細胞がいると仲間じゃない=非自己とみなされ、
細胞傷害性Tリンパ球(CD8陽性Tリンパ球,キラーT細胞:CTL)という殺し屋に殺されてしまいます。
主にウイルス感染細胞が作るウイルスタンパク質、ガン細胞がつくるタンパク質の断片と結合すると、クラスⅠMHC分子に結合した抗原情報は、細胞傷害性Tリンパ球(CD8陽性Tリンパ球,キラーT細胞:CTL)によって認識されます。
クラスⅡMHC
インフルエンザウイルスが体の中へ入ると、
細胞感染するウイルスと、マクロファ-ジに貪食され、その断片をヘルパ-T細胞へ抗原提示されるものとがいます。
インフルエンザウイルスの断片を
ヘルパ-T細胞へ提示するマクロファ-ジの両手のような分子をクラスⅡMHC分子といいます。
一方、クラスⅡMHC分子に結合したウイルス断片を認識するヘルパ-T細胞の手のような分子はT細胞レセプタ-(T細胞受容体)と呼ばれます。
抗原提示細胞としては下記の免疫細胞があげられます。
マクロファ-ジ、樹状細胞、B細胞
グラム陽性菌
腸内常在菌はグラム陽性菌とグラム陰性菌に分けられます
【グラム陽性菌】
グラム染色と呼ばれる細菌の染色法で青く染まる表層を持ちます。グラム陽性菌は、一番外側に厚い細胞壁を持っていて、その内側は脂質で作られた細胞膜があります。
代表的なグラム陽性菌は、枯草菌(納豆菌)、乳酸菌、ブドウ球菌、ボツリヌス菌です。
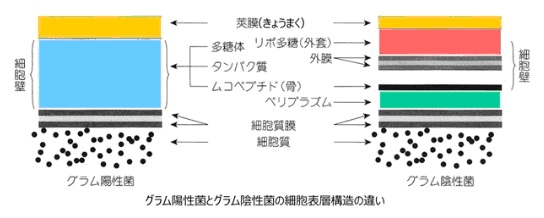
【グラム陰性菌】
グラム染色と呼ばれる細菌の染色法で赤く染まる表層を持ちます。
グラム陰性菌は、脂質の外膜を持っていて、その内側にペプチドグリカンの薄い層を持っています。さらにその内側に、脂質で作られた細胞膜を持っています。外膜と細胞膜の2つの層に挟まれた薄いペピチドグリカンとの間にはペリプラズムと呼ばれる空間があります。
代表的なグラム陰性菌は、大腸菌です。
グラム陰性菌の細胞壁にはポーリンと呼ばれ、人の口に相当する構造があります。
グリコサミノグリカン
長鎖の通常枝分れがみられない多糖。
動物の結合組織を中心にあらゆる組織に普遍的に存在する。
狭義のムコ多糖。GAGと略される。
硫酸基が付加した2糖の繰り返し構造からなる。
うち1つはアミノ糖(ガラクトサミン、グルコサミン)であり、もう1つはウロン酸(グルクロン酸、イズロン酸)またはガラクトースである。
多数の硫酸基とカルボキシル基を持つために、強く負に帯電している。
多くのグリコサミノグリカンは、プロテオグリカンとしてコアタンパク質と呼ばれる核となるタンパク質に付加した形で存在している。
唯一の例外は、ヒアルロン酸であり、プロテオグリカンとしては存在していない。
主なグリコサミノグリカン:ヒアルロン酸、コンドロイチン4-硫酸(コンドロイチン硫酸A)、コンドロイチン6-硫酸(コンドロイチン硫酸C)、デルマタン硫酸(コンドロイチン硫酸B)、ケラタン硫酸、へパラン硫酸、ヘパリン。
グルクロン酸抱合
肝臓はからだの中でいちばん大きな化学工場であり、生体にとって有害な物質を無害な物質に変化させる解毒機構を有している。
グルクロン酸は水に対し高度に可溶性の物質である。
そのため動物体内において、
グルクロン酸はしばしば体外への排出のために毒物と結合されたり、輸送しやすくするためにホルモンと結合されたりする。
この過程はグルクロン酸化あるいは
グルクロン酸抱合 (glucuronidation) と言う。
グルクロン酸抱合は最も大きな解毒機構であるが、このほか水酸化、メチル化、アセチル化、エーテル硫酸化、グリシン抱合、システイン抱合などの解毒機構があり、いずれも脂溶性の高い化合物を水溶性の化合物に代謝し、排出されやすくする。
しかし、これらの解毒機構により必ずしも毒性が低下するばかりとはいえない。
赤血球は骨髄で生成され、古くなったり損傷を受けた赤血球は脾臓で分解される。
ヘモグロビンも分解され、グロビンがアミノ酸に分解されるようにヘムも分解される。
脾臓の細網内皮系(細網細胞)でヘムは非抱合型ビリルビンへと分解される。
非抱合型ビリルビンは水に溶けない。
それゆえアルブミンと結合して肝臓へと送られる。
非抱合型ビリルビン(間接ビリルビン)は、肝臓でグルクロン酸抱合を受け、抱合型ビリルビン(直接ビリルビン)となる。
この代謝は、グルクロン酸抱合であり、肝臓の解毒作用の一種 です。
グルコーストランスポーター1(GUT1)
グルコース(ブドウ糖)は、ほとんどの細胞の代謝に不可欠な基質である。
グルコースの分子は極性を有するため、生体膜を通過するのには特別な膜輸送タンパク質を必要とする。
能動輸送 - 共役輸送タンパク
小腸の頂端膜や腎臓の上皮細胞を通るグルコースの輸送は、二次的に活性化されるナトリウム-グルコース共輸送体タンパクのSGLT-1およびSGLT-2の存在に依存する。
SGLTはsodium-dependent glucose transporter の略称である。これらは、ナトリウムイオン共輸送体のつくるNa+の電気化学的勾配によって供給されるエネルギーを利用して、グルコースの細胞内濃度を高める。
受動輸送 - GLUT
細胞膜を通過するグルコースの能動輸送は、輸送促進タンパクのスーパーファミリーのひとつに属するグルコース輸送体(表記は、タンパクとしてはGLUT、遺伝子では溶質キャリヤータンパクファミリー2 (Solute Carrier Family 2)を略しSLC2と表される)によって触媒される。
このスーパーファミリーには、有機アニオンおよびカチオントランスポーター、酵母ヘキソーストランスポーター、植物ヘキソース/プロトン共輸送タンパク、細菌糖/プロトン共輸送タンパクなどが含まれる。
これらの輸送タンパクによって引き起こされる分子の移動は、促進拡散により起こる。
このため、能動輸送タンパクがその輸送機構を進行させるのにATPの存在を要求し、ATP/ADP比があまり低下すると立ち往生してしまうのとは異なり、促進拡散輸送タンパクはエネルギーがなくとも機能できる。
グルコーストランスポーターの各アイソフォームは、グルコースの代謝において、組織発現のパターン、基質特異性、輸送速度論、異なる生理学的状況においての発現調整によって定められた、特色ある役割を果たす。
これまでに、13種類のGLUT/SLC2が同定されている。
アミノ酸配列の類似性に基づいて、GLUTファミリーは3つのサブクラスに分類されている。
クラスIには、目立った特徴を持つグルコーストランスポーターであるGLUT1からGLUT4までが含まれる。
血中のグルコースを脳内に取り込むGLUT1はインスリンでも反応するがインスリンの有無に関わらずGLUT1は細胞膜上に存在してグルコースを取り込む。
成人では、赤血球で最も高頻度に発現しており、また血液脳関門のような関門組織の内皮細胞にも発現している。
しかし、すべての細胞で、呼吸を維持していくのに必要な最低限のグルコース取り込みに深く関わっている。
グルタチオン(Glutathione, GSH, Glutathione-SH)
グルタミン酸、システイン、グリシンが、この順番でペプチド結合したトリペプチドである (L-γ-glutamyl-L-cysteinyl-glycine)。
ただし、グルタミン酸とシステインの結合は通常のペプチド結合とは異なり、グルタミン酸側鎖のγ-カルボキシ基とシステイン主鎖のα-アミノ基からなる(γ-グルタミル結合)。このためグルタチオンは、ペプチドでありながら、ほとんどのプロテアーゼに対して耐性であり、分解されない。
グルタチオンを直接分解できる酵素はγ-グルタミルトランスペプチターゼや、その近縁のごく限られた酵素のみである。
グルタチオンの生理的機能は多々あるが、主要な機能は大きく2つに分けることができる。
ひとつは
細胞内のチオール環境を維持することである。
チオールは生体内の主要な抗酸化成分である。グルタチオンは自らのチオール基を用いて
過酸化物や活性酸素種を還元して消去する。
また、タンパク質中のジスルフィド結合を還元して2つのチオール基に戻す。
更に、グルタチオンは細胞のシステイン源でもあり、システインはチオール基を含む。
もうひとつの主要な生理機能は、
様々な毒物・薬物・伝達物質等を細胞外に排出することである。
グルタチオンはこれらの物質を、やはりシステイン残基のチオール基に結合させ(グルタチオン抱合)、自ら細胞外に排出されることで、細胞を解毒する。
酸素は好気呼吸を行う生物にとって欠くことができないが、その反面、過酸化水素や酸素ラジカル(活性酸素種)が発生する原因ともなる。活性酸素種は反応性が高く、脂質やタンパク質を無秩序に酸化し(過酸化物)、生体に深刻なダメージを与える(酸化ストレス)。このため好気呼吸を行う生物は活性酸素種を消去し(還元して酸素や水に戻す)、また活性酸素種によってダメージを受けた部分を修復する機構を備えている。
細胞内の主要な抗酸化成分はチオールであり、グルタチオンはチオールを有する生体物質の中では細胞内に最も豊富に存在する。グルタチオンは、細胞内で発生した活性酸素種や、過酸化物と反応してこれを還元し、消去する。過酸化物の消去はグルタチオンペルオキシダーゼによって触媒され、活性酸素種はグルタチオンが直接反応する。いずれの反応においてもグルタチオンは相手を還元し、自らは酸化される。グルタチオン還元酵素は、NADPHの還元力を利用して酸化型グルタチオンを直ちに再還元する(参考: 酸化型グルタチオンの酸化還元電位 GSSG + 2 e → 2 GSH: ?240 mV[4])。このため、還元型グルタチオンの濃度は通常一定に保たれており、これは細胞内のチオール濃度が一定に保たれていることも意味する。何らかの原因で還元型と酸化型の比率が大きく崩れた場合は、酸化型グルタチオンが細胞外に積極的に排出される。
グルタチオンはタンパク質中のジスルフィド結合の切断にも関与している。グルタレドキシンの触媒作用によってジスルフィド結合が還元され二つのチオール基に戻り、グルタチオンは酸化される。この反応は「チオール交換反応」と呼ばれる。
また、グルタチオンは細胞のシステイン源でもある。
グルタチオンは、細胞外にあるγ-グルタミルトランスペプチターゼとジペプチターゼによって、構成アミノ酸であるグルタミン酸、システイン、グリシンにまで分解された後、細胞内に取り込まれる(大腸菌ではジペプチターゼは細胞内にある)。
これらはアミノ酸源として利用される他、細胞内のグルタチオン再合成にも使われる。
システインは単独で存在すると、容易に二分子が反応してシスチンとなり、その際ラジカルを発生する。
このため、細胞中のシステイン濃度は比較的低く抑えられており、グルタチオンがシステインの貯蔵庫として利用されると考えられる。
また酵母では、グルタチオンは、窒素源としても利用されると考えられている。
グルタチオンはシステイン残基のチオール基に様々な物質を結合する。
これらには、毒物や、抗生物質などの薬物、ロイコトリエンやプロスタグランジン等といった各種伝達物質が含まれる。
グルタチオン-S-トランスフェラーゼ (GSTs) によってこれらの結合反応が触媒される。
また、ある種の金属イオンは非酵素的にグルタチオンと結合する。
グルタチオンとこれらの物質の結合物(抱合体)は細胞外に排出され、細胞から有害物質が取り除かれる。
哺乳類の場合は抱合体は血中を移動し、腎臓まで運ばれる。
腎臓でこの抱合体はメルカプツール酸に変換され、胆汁中や尿中に排出される。
グルタチオンは、代謝の副産物として産生するメチルグリオキサルの代謝にも必要である。メチルグリオキサルは、非酵素的にグルタチオンに抱合される。
抱合されたメチルグリオキサルは、グリオキシラーゼI および II によって D-乳酸に変換され、グルタチオンから切り離される。
クロストーク
細胞膜上・細胞質中の因子が次々にシグナルを受け渡しながら他の経路とも影響し合うことをクロストークと言い、最終的には核内の転写因子による特定遺伝子の転写調節(さらにそれによる細胞の変化)や、アポトーシスによる細胞死などの効果をもたらす、というものとなる。
この流れは、基本的に、細胞間で行なわれるものと、細胞内で行なわれるものとに分けることができる。
この場合、細胞膜上の受容体において、細胞外シグナルから細胞内シグナルへの変換が行なわれる。
細胞外シグナルの媒体は、ホルモンに代表されるようなシグナル分子であり、これに対し、細胞内シグナル分子はセカンドメッセンジャーと通称される。
ただしステロイドホルモンなどの場合は、細胞外シグナル分子が細胞膜を透過し、そのまま細胞内シグナル分子として機能し、細胞質内の受容体に働きかけて、直接転写を制御する。このような反応は1ミリ秒ほどの時間で起きる。
多くの場合、最初の刺激から過程が進むにつれ、関与する酵素や分子の数が増大する。
このような反応の連鎖は「カスケード」と呼ばれ、弱い刺激から大きな反応を誘導すること(増幅作用)ができる。
クロストリジウム属
真正菌目バチルス科に属する偏性嫌気性の細菌。
グラム陽性で、胞子(芽胞)を形成する。
自然界、とくに土壌中に広く分布し、あるものは腸内細菌叢の仲間である。
19世紀の中ごろパスツールによって発見され、その後、この属の細菌が酪酸発酵を行うことが実証された。
この属の細菌による重要な疾病には破傷風(C. tetaniによる)とガス壊疽(えそ)(C. perfringensと他の化膿(かのう)菌との混合感染)があり、食中毒にはボツリヌス食中毒(C. botulinumによる)とウェルシュ菌食中毒(C. perfringensによる)がある。
これらは、いずれも菌体外毒素(有毒タンパク質)が生産されるためである。
この属の菌は分子状酸素に対して感受性が高く、栄養細胞は空気に接触すると瞬間的に死滅するが、胞子は空気に対して感受性はない。
土壌中や水系中ではタンパク質や繊維素の分解者として重要な生物であり、分解されたものは多種のガスや分解生成物となって、他の生物に利用される
クロマチン(chromatin)
真核細胞内に存在するDNAとタンパク質の複合体のことを表す。
クロマチンの構造:1つの核に納められているDNAの総延長はおよそ2mと言われている。これを10μmの核に収納するための構造がクロマチンである。
血管性ニッチ (Vascular niche)
骨髄内では内骨膜上とは別に、類洞血管内皮細胞に造血幹細胞とCAR細胞が接着して存在することも分かっている。これを血管性ニッチと呼ぶ。血管性ニッチでは造血幹細胞の維持に加え、造血幹細胞自身の増殖や血液細胞への分化にも多く関わっている。
血管性ニッチを構成する細胞にはAng-1などの造血幹細胞細胞の維持に関わる因子を発現するCAR細胞や遊走に必要な因子であるSDF-1などを発現する細胞などがあり、同様に血管周辺に存在する巨核球もAng-1を産出するなど多くの細胞が関わっていると考えられている。
血管性ニッチ環境は骨芽細胞性ニッチに比べ高酸素状態であり、造血幹細胞の細胞周期は活性化されやすい。
実際、骨芽細胞性ニッチに比べると多くの造血幹細胞が細胞分裂の周期に入っていると考えられている。
血管性ニッチは末梢血流に接しているので、造血幹細胞が内皮細胞の間をくぐり抜けて末梢血に入り、他の造血組織に移動することもある。
血小板第4因子
血小板に固有の血液凝固に関与するタンパクで、ヘパリンに強く吸着することにより、ヘパリンの凝血阻止作用を阻害する。
ヘパリン:抗凝固薬の一つであり、血栓塞栓症や播種性血管内凝固症候群 (DIC) の治療、人工透析、体外循環での凝固防止などに用いられる。
肝細胞から発見されたため "heparin" と名付けられた(hepato- は「肝の」という意味)が、小腸、筋肉、肺、脾や肥満細胞など体内で幅広く存在する。
化学的にはグリコサミノグリカンであるヘパラン硫酸の一種であり、β-D-グルクロン酸あるいは α-L-イズロン酸と D-グルコサミンが 1,4 結合により重合した高分子で、ヘパラン硫酸と比べて硫酸化の度合いが特に高いという特徴がある。
この分子中に多数含まれる硫酸基が負に帯電しているため、種々の生理活性物質と相互作用する。
生体内において肝臓で生成される。ヘパリンは細胞表面に存在し、種々の細胞外マトリクスタンパク質と相互作用している。それらのタンパク質の中には、上記の抗凝固作用に関与する凝固系や線溶系のタンパク質の他に、種々の成長因子、脂質代謝関連タンパク質など100を超える種類のタンパク質が含まれ、細胞増殖や脂質代謝にも関与している
血小板由来成長因子(:Platelet-Derived Growth Factor、PDGF)
間葉系細胞(線維芽細胞、平滑筋細胞、グリア細胞等)の遊走および増殖などの調節に関与する増殖因子であり、PDGF/VEGFファミリーに属する。
主に巨核球によって産生されるほか、血小板のα顆粒中にも含まれる。
PDGFは上皮細胞や内皮細胞など様々な細胞によって産生されることが分かっている。PDGFにはPDGF-A、B、CおよびDの少なくとも4種類が存在するが、A鎖およびB鎖はジスルフィド結合を形成することによりホモあるいはヘテロ2量体構造をとり3種類のアイソフォーム(PDGF-AA、AB、BB)を有している。
PDGFはチロシンキナーゼ関連型であるPDGF受容体(PDGFR)を介してその生理作用を発現することが知られている。
血清
血液が凝固して上澄みにできる淡黄色の液体成分のこと。
血液から細胞成分を除いたものを血漿といい、血清と同一視されがちであるが、同じものではない。
血漿から線維素原と凝固因子を(凝固によって)除いたものが血清で、アルブミンやグロブリンなどの蛋白質を含んでいます。
黄疸(おうだん)指数は、血清の黄褐色の色調を調べたものである。(ビリルビンの濃度)
血清学的検査 CRP(C-反応性蛋白)RA・ASLO 腫瘍マーカー
血清乳酸脱水素酵素(LDH) 尿酸(UA) 血清尿素窒素(BUN) クレアチニン(Cre)等
血流によるずり応力
血管の内面を一層に覆う内皮細胞は、血液の流れに直接さらされるという、他の細胞にはない特別な環境におかれている。
このことは内皮に血液中の物質がむやみに血管外へ浸み出さないようにする抗物質透過性、あるいは血液が血管内で凝固しないようにする抗血栓活性が備わっている理由となっているが、一方、血流に起因する機械的刺激がつねに内皮細胞に作用することを意味している。
この機械的刺激とは血液の粘性と流速(速度勾配)の積で決まる壁ずり応力(wall shear stress)のことで、内皮細胞を血流の方向に歪ませる作用がある。
血管内皮は、血液と組織を境する抗物質透過性・抗血液凝固性の内張りの役割だけでなく、種々の平滑筋収縮・弛緩物質を放出し血管のトーヌス(筋緊張)を調節したり、細胞増殖因子を産生して血管の成長やリモデリングにも積極的にかかわっている。
さらに、多くの生理活性物質や接着分子を介して他の細胞とも活発な相互作用を営んでいる。
こうした生体にとって重要でかつ多彩な内皮の機能は、ホルモン、
オータコイド、サイトカイン、神経間伝達物質などのいわゆる化学的刺激により調節を受けるだけでなく、内皮が接している血流に基づくずり応力といった機械的刺激によっても修飾されることがわかってきた。
たとえば、ずり応力は内皮を刺激して血管拡張物質である一酸化窒素(nitricoxide;NO)や細胞増殖作用のある血小板由来増力因子(platelet derived growth factor;PDGF)などの産生を促進させることが知られている。
最近、こうしたずり応力が内皮細胞の機能を修飾するとき、多くの場合、その機能に関連した遺伝子の発現が変化していることが判明した。
さらに、ずり応力に応答する遺伝子には共通したずり応力応答配列(shear stress responsive element;SSRE)が存在するとの報告がなされ、
血流による内皮機能の制御のメカニズムの一部が今まさに解明されようとしている。
ゲノム塩基配列決定法
一般に、ゲノム解析とは特定の生物種のゲノム塩基配列をすべて決定することと理解されている。
じつは、このようなゲノム解析は、より正確には
ゲノムの構造解析とよばれている。
ゲノムの全塩基配列を決定し、そこに書かれた遺伝子をすべて同定して
アミノ酸配列を決定することが、ゲノムの構造解析である。
しかしながら、
ゲノムの構造解析が終わっても、遺伝子のはたらきなど、ゲノムに書かれた情報の意味がすぐに理解できるわけではない。
実際、これまでに決定されたどの生物種のゲノムにおいても、どんなはたらきをしているのかまったくわからない遺伝子が半分程度も残っている。
そこで
ゲノムの構造解析の次のステップとして、ゲノムの機能解析がゲノム研究の新しい流れになっている。
ゲノムの構造解析は、システマティックな
シークエンシング(塩基配列決定)法によって行われ、その結果得られる主な情報は、
・配列情報(塩基配列、アミノ酸配列)
・遺伝子位置の情報
である。
一方、ゲノムの機能解析ではDNAチップをはじめさまざまな実験手法が開発されつつあり、その結果
・ゲノム変異情報
・遺伝子発現情報(トランスクリプトーム)
・タンパク質発現情報(プロテオーム)
・タンパク質間相互作用情報
などに関するデータが大量に産み出されつつある。
そして、
病気の原因となる遺伝子などが解明されていくものと思われる。
塩基配列決定法の種類については、マクサム・ギルバート法とサンガー方があり、現在はほとんど後者が用いられている。
ケモカイン(Chemokine)
Gタンパク質共役受容体を介してその作用を発現する塩基性タンパク質であり、サイトカインの一群である。白血球などの遊走を引き起こし炎症の形成に関与する。1987年にIL-8が同定されて以来、数多くのケモカイン分子が新しく発見されてきた。ケモカインは構造上の違いからCCケモカイン、CXCケモカイン、Cケモカイン及びCX3Cケモカインに分類される。これまでに50種類以上のケモカインが同定されている。
嫌気性生物
増殖に酸素を必要としない生物である。
多くは細菌であるが、古細菌や真核微生物の中にも存在する。
これらは主に、酸素存在下で酸素を利用できる通性嫌気性生物と、大気レベルの濃度の酸素に暴露することで死滅する偏性嫌気性生物に分けられる。
酸素を利用することはできないが、大気中でも生存に影響がない生物は、耐酸素性細菌などと呼ばれる。
抗体
生体にウイルス、細菌、その他の細胞や動植物の成分などの抗原が侵入すると、生体の免疫系が刺激され、やがてそれらの侵入物に特異的に結合できるタンパク質が合成されて、細胞表面、血清その他の体液中に出現する。このタンパク質が抗体である。
抗体産生細胞:抗原の侵入に対する生体免疫系の反応、すなわち免疫応答の主体をなす細胞はリンパ球系の細胞であって、これは胸腺由来リンパ球(T細胞)と骨髄由来リンパ球(B細胞)に大別される。
抗微生物ペプチド
進化的に保存された自然免疫反応の1種として機能するペプチドの総称であり、あらゆる種類の生命で認められる。
原核生物と真核生物の細胞には基本的な違いがあり、それは抗微生物ペプチドの標的の違いを表しているのかもしれない。
これらの
ペプチドは薬効を持ち、広いスペクトルをもつ抗生物質であり、新規治療薬としての可能性を示している。
抗微生物ペプチドはグラム陰性およびグラム陽性細菌(通常の抗生物質に耐性のある種を含む)、マイコバクテリウム属 (結核菌を含む)、エンベロープを持つウイルス、真菌、および形質転換した細胞またはがん細胞でさえ殺すことが示されている。
通常の抗生物質の多くとは異なり、抗微生物ペプチドは
免疫調節薬として機能することで免疫力を高めることができるようにみえる。
免疫調節活性
抗微生物ペプチドは、直接細菌を殺すことに加え、多くの免疫調節剤としての機能も持つことが示されている。
その機能には、宿主の遺伝子発現を変える力、ケモカインとして、あるいはケモカイン産生を誘導する作用、リポ多糖によって誘導される炎症誘発性ケモカイン産生の阻害、傷の回復促進、樹状細胞と獲得免疫反応に関する細胞の反応を調節して感染の除去に関わるかもしれない。
動物モデルでは、宿主の防御ペプチドが感染の予防と除去に重要であることが示された。多くのペプチドが初めは「抗微生物ペプチド」として単離されても、名付けられた「抗微生物ペプチド」が生体内では別にもっと重要な機能があると示されることがある(例えば、ヘプシジン )。
これらのペプチドは、新規治療薬および従来の抗生物質治療の新規補助剤の開発における非常に有力な候補である。
それは、従来の抗生物質と比べ、抗生物質耐性を引き起こすように見えないが、一般に広範囲な活性を持っており、静菌的ではなく殺菌的であり、殺菌の誘導が短時間に起こるからである。
非常に多くの天然ペプチドとそれらの派生物が、口腔粘膜炎、嚢胞性線維症(CF)に関連している肺の感染症、
がん、および典型的な皮膚感染症にわたるさまざまな疾患に対する新規抗伝染病療法として開発されてきた。
ペクシガナンは糖尿病による足の壊疽を関係した感染症の治療で役に立つことが示されている。
抗微生物ペプチドの選択性
抗微生物ペプチドに対して細菌細胞と宿主細胞が競合した場合、抗微生物ペプチドは哺乳類細胞より細菌細胞と相互作用しやすく、そのため哺乳類細胞にはあまり毒性を与えずに微生物を殺すことが可能となっている。
選択性は抗微生物ペプチドの非常に重要な性質であり、それが宿主の防衛システムでの抗生物質としての機能を保証している。
細菌の耐性
細菌は、さまざまな耐性戦略を使い、抗微生物ペプチドによる死を防ぐ。
微生物には、表面の正味の電荷を変化させるものもある。
「黄色ブドウ球菌」は、D-アラニンを細胞質から表面のテイコ酸へ輸送し、塩基性アミノ酸によって引き起こされる正味の負の電荷を減じる。
「黄色ブドウ球菌」は、その陰イオン性の膜をMprFを介してL-リジンで修飾し、正味の正の電荷を増やす。
「肺炎桿菌」のカプセル多糖は抗微生物ペプチドが膜ターゲットと相互作用するのを制限する。
リピドAにも変化が起こる。
「サルモネラ」属は、ミリスチン酸の付加により増加したリピドAと2-ヒドロキシミリスチン酸を持つリピドAとの間の疎水的相互作用を増加させ、パルミチン酸の付加によりヘプタアシル化リピドAを形成することにより、外膜の流動性を減少させる。増加した疎水的モーメントにより、抗微生物ペプチドの挿入と小孔形成が遅れる、または阻止される。
膜タンパク質を変更させるものもある。
いくらかのグラム陰性細菌では、外膜タンパク質の生産を変えることが、抗微生物ペプチドによる殺菌への抵抗に関係している。
ATP結合カセット(ABC)トランスポーターは抗微生物ペプチドを取り込み、resistance-nodulation cell-division efflux pumpで排出する。
このトランスポーターは両方とも抗微生物ペプチド耐性に関係している。細菌はタンパク質分解酵素を分泌し、それが抗微生物ペプチドを分解し、耐性を持たせているかもしれない。
骨芽細胞性ニッチ(Osteoblastic niche)
骨髄の奥深く、内骨膜上に存在するSNO細胞(N-cadherin陽性であり、紡錘型の骨芽細胞)は内骨膜の表面に接着し、その表面にN-cadherinタンパクを持つ。造血幹細胞もN-cadherin(カドヘリンタンパク)を持ち、SNO細胞と造血幹細胞はN-cadherinタンパクを介して接着している。
また、SNO細胞と造血幹細胞はそれぞれその表面に多数のレセプターを持ち、互いに多種類のシグナルの交換をしているが、その中でも重要なものにはAng-1/Tie2シグナルとTHPO/Mplシグナルがある。
SNO細胞と造血幹細胞がN-cadherinタンパクを介して接着している状態で、SNO細胞が放出したリガンドAng-1(アンジオポエチン)が造血幹細胞のTie2レセプターに取り込まれると、造血幹細胞では細胞周期のG0期(細胞分裂が行われない静止期)が維持され、また細胞のアポトーシスが起こらないようになる。
また、Ang-1/Tie2シグナルはN-cadherinタンパクを介して接着をより強固にする働く。
また、SNO細胞が放出るTHPO(トロンボポエチン)をリガンドとし、Mplレセプターに作用するTHPO/Mplシグナルも定常状態では同様に造血幹細胞の静止と細胞接着に働く(ただし、THPO/Mplシグナルが定常状態を超えて抗進された場合には逆に造血幹細胞の増殖を誘導する。)
また、骨芽細胞性ニッチにはCAR細胞や破骨細胞なども存在し、それらの細胞も造血幹細胞のコントロールに関わっている。
ニッチにおいて骨芽細胞と同様に造血幹細胞に接着しているCAR細胞はCxcl12ケモカインを産出し、それによって造血幹細胞が持つCxcr4レセプターにシグナル伝達が行われると、それも造血幹細胞の静止状態の維持に重要な役割をはたすと考えられている。
骨髄の奥に存在する骨芽細胞性ニッチは低酸素状態に置かれている。
活性酸素による酸化ストレスは細胞を傷つけるが、低酸素状態の骨芽細胞性ニッチでは酸化ストレスが弱く細胞の維持には好都合である。
また、低酸素状態は骨芽細胞の数の維持にもつながっていると考えられている。
骨軟部腫瘍
骨(ほね)にできた腫瘍と、骨よりやわらかい軟部組織(おもに筋肉、脂肪組織、皮下、結合組織、末梢神経など)に発生する腫瘍を総称した言い方です。
コラーゲン
真皮、靱帯、腱、骨、軟骨などを構成するタンパク質のひとつで、多細胞動物の
細胞外基質(細胞外マトリクス)の主成分である。
体内に存在しているコラーゲンの総量は、ヒトでは、全タンパク質のほぼ30%を占める程多い。
コラーゲンタンパク質のペプチド鎖を構成するアミノ酸は、"―(グリシン)―(アミノ酸X)―(アミノ酸Y)―" と、グリシンが3残基ごとに繰り返す一次構造を有する。
この配列は、
コラーゲン様配列と呼ばれ、コラーゲンタンパク質の特徴である。
例えば、
I型コラーゲンでは、この "―(グリシン)―(アミノ酸X)―(アミノ酸Y)―" が1014アミノ酸残基繰返す配列を持っている。
コラーゲンのアミノ酸組成はグリシンが約1/3を占め、プロリン及びヒドロキシプロリンが21%、アラニンが11%とかなり偏った構成となっている。
またコラーゲンに特有のアミノ酸としてヒドロキシプロリン・ヒドロキシリジンなどがある。
これらは通常のプロリン・リジンに対して水酸基が1つ付加した構造のアミノ酸で、他のタンパク中にはほとんど含まれない。
これらは水素結合によってタンパク鎖同士を結び、3重らせん構造を保つ働きがある。
ヒドロキシプロリン・ヒドロキシリジンはいずれもタンパク合成の際に組み込まれるのではなく、まずそれぞれプロリン・リジンの形で合成され、タンパク鎖が形成された後で酸化酵素により付加される(翻訳後修飾)。
またこの反応の際には
ビタミンCを補酵素として、鉄を補因子として必要とするため、ビタミンCを欠いた食事を続けていると正常なコラーゲン合成ができなくなる。
コラーゲンは、様々な結合組織に、力学的な強度を与えるのに役立っている。若干の弾力性もある。特に、腱の主成分は上述のコラーゲン繊維がきちんとすきまなく配列したもので非常に強い力に耐える。
一方、こうした従来から知られている機能とは別に、
コラーゲンが、それに接する細胞に対して、増殖、分化シグナルを与える、情報伝達の働きも担っていることがわかってきている。
コンドロイチン硫酸プロテオグリカン
コンドロイチン硫酸のほとんどは、プロテオグリカンとして細胞外マトリックスや細胞表面に存在している。
その機能で代表的なものは、軟骨のコンドロイチン硫酸である。
軟骨のコンドロイチン硫酸の多くは、アグリカンというプロテオグリカンとして存在し、ヒアルロン酸、リンクタンパク質とともに超高分子複合体を形成している。
この複合体は、軟骨特有なII型コラーゲンとともに、軟骨の細胞外マトリックスを形成し、軟骨の持つクッション作用に重要な役割をしている。
皮膚に多く存在するデコリンは、コラーゲン繊維に結合し細胞外マトリックス形成の調節を行う。
その他の組織のコンドロイチン硫酸もプロテオグリカンとして、多くは細胞外マトリックスの形成に関与し、細胞接着、移動、分化、増殖など細胞形質の制御を行っていると考えられている。
脳においては、神経線維の再生を阻害する因子のひとつとして知られるほか、神経細胞の回りを取り巻く構造であるperineuronal netの主要成分として脳機能の可塑性に関与するとされる。
やや特殊な機能をするコンドロイチン硫酸としては、マスト細胞やナチュラルキラー細胞の細胞内顆粒に存在するものなどもある。
▼ カ行先頭へ