ユビキチン・プロテアソームシステムの破綻ががん等の難治疾患の原因
プロテアソームは、標的タンパク質を分解するための目印となるユビキチンと連携して選択的にタンパク質を分解することにより、生命活動に必須な役割を果たしています。
プロテアソームは、分子量250万、総サブユニット数約100個から構成された生命科学史上もっとも巨大で複雑な酵素複合体とされています。
20世紀後半、生命科学の中心テーマは "遺伝子からタンパク質合成に至る研究"、すなわち「たんぱく質の生の生物学」でありました。
一方、近年"タンパク質の分解"、すなわち「タンパク質の死の生物学」の研究が飛躍的に進展し、タンパク質分解がタンパク質合成と同様に生命活動の基本要素であることが明らかにされてきました(図1)。
その象徴的な出来事として
2004年ノーベル化学賞が「ユビキチン依存性タンパク質分解機構の発見」のテーマに授与されたことが挙げられます。
この新しい概念が提案されるに至った原動力は、タンパク質分解のシグナル分子であるユビキチン(図2)とタンパク質分解酵素複合体であるプロテアソーム(図3)の発見でありました。
ユビキチン・プロテアソームシステム(図1)は選択的なタンパク質分解を担う大掛かりな細胞内装置であり、細胞周期・アポトーシス・代謝調節・免疫応答・シグナル伝達・転写制御・品質管理・ストレス応答・DNA修復など生命科学のあらゆる領域で中心的な役割を果たしていることが明らかにされてきました。
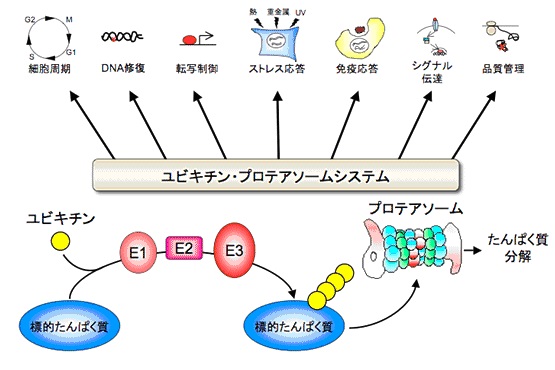 図1.ユビキチン・プロテアソームシステム
図1.ユビキチン・プロテアソームシステム
標的タンパク質に対してE1, E2, E3の酵素反応のカスケードによりユビキチン分子が付加されることが繰り返されると、それが分解の目印となりプロテアソームにより認識されて分解に導かれる。
標的タンパク質の選択はE3により行われる。このユビキチン・プロテアソームシステムは細胞周期、DNA修復をはじめとしたあらゆる細胞機能制御に中心的役
割を果たしている。
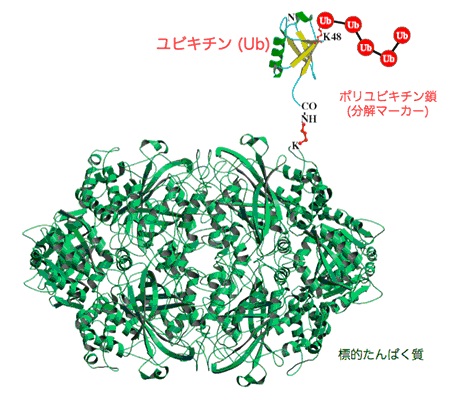 図2.ユビキチンが標的たんぱく質を分解するための目印となるイメージ図
図2.ユビキチンが標的たんぱく質を分解するための目印となるイメージ図
標的タンパク質のリジン残基(K)にユビキチンのカルボキシル末端が共有結合され、そのユビキチンの48番アミノ酸のリジン残基(K48)にさらにユビキチンが共有結合することを繰り返すことにより,ポリユビキチン鎖が形成され、プロテアソームにより認識されるシグナルとなる。
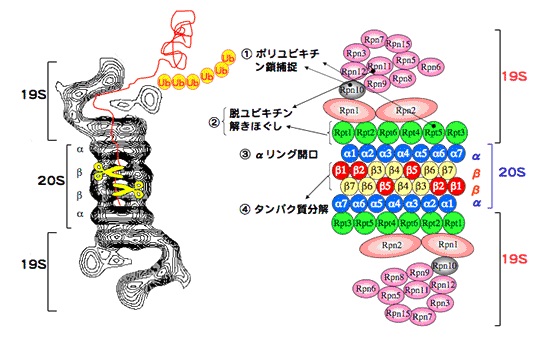 図3.26Sプロテアソームの構造(模式図)
図3.26Sプロテアソームの構造(模式図)
左図は電子顕微鏡像、右図はサブユニット構成の模式図。26Sプロテアソームは一つの20Sプロテアソームと二つの19S複合体からなる。
タンパク質分解活性を有するのは20Sプロテアソームであり、19S複合体はその機能調節を行います。
20Sプロテアソームはα1-7、β1-7の14種類、総計28個のサブユニットより構成されています。
この複合体がどのようにして形成されるかは大きな謎でありましたが2006年、プロテアソームの分子集合反応を促進する新しい分子シャペロンとしてPAC1-PAC2複合体を発見し、プロテアソーム形成の分子機構の解明がされました。
近年、
がん、神経疾患、免疫疾患をはじめとする様々な難治疾患はプロテアソームとユビキチンから構成されるタンパク質分解装置の破綻が原因である>ことが知られるようになりました。
そのため、プロテアソーム形成の分子機構の解明はこれらの難治疾患の理解に大きく貢献し、その治療法の開発へとつながることが期待されています。

